Helium
Helium är grundämne nummer två i det periodiska systemet, en färglös och luktlös ädelgas. Ämnet har lägst kokpunkt av alla grundämnen, och endast vid högt tryck övergår det i fast form.
| Helium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Röd–orange glöd i plasmatillståndet Emissionsspektrum | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Generella egenskaper | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Relativ atommassa | 4,002602(2)[1][2] u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Utseende | Färglös i gasform | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fysikaliska egenskaper | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitet vid 0 °C | 0,1785[3][4] g/L | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| – flytande, vid smältpunkten | 0,145 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| – flytande, vid kokdpunkten | 0,125 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregationstillstånd | Gas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Smältpunkt | 0,95 K (−272,20 °C) (2,5 MPa) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kokpunkt | 4,222 K (−268,928 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Trippelpunkt | Nedre λ-punkt: 2,177 K (−270,973 °C) 5,043 kPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kritisk punkt | 5,1953 K (−267,9547 °C) 0,22746 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molvolym | 22,4 × 10−3 m³/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Smältvärme | 0,0138 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ångbildningsvärme | 0,0829 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Specifik värmekapacitet | 5,2 × 103[5] J/(kg × K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molär värmekapacitet | 20,786[6] J/(mol × K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomära egenskaper | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradie | 31 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalent radie | 28 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| van der Waalsradie | 140 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronaffinitet | 0 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jonisationspotential | Första: 2 372,3 kJ/mol Andra: 5 250,5 kJ/mol (Lista) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronkonfiguration | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
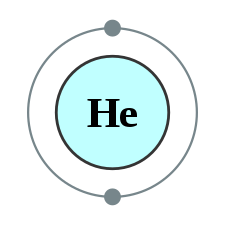
| Elektronkonfiguration | 1s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| e− per skal | 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kemiska egenskaper | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationstillstånd | 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativitet | Ingen uppgift (Paulingskalan) 5,5 (Allred&Rochow) 4,86 (Mulliken) 5,2[7] (medelvärde) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diverse | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | Hexagonal tätpackad (hcp)  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ljudhastighet | 972 m/s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Värmeledningsförmåga | 0,142[5] W/(m × K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetism | Diamagnetisk[8] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetisk susceptibilitet | −1,1 × 10−9 [9] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brytningsindex | 1,000035 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identifikation | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-nummer | 7440-59-7 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EG-nummer | 231-168-5[10] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pubchem | 23987 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| RTECS-nummer | MH6520000 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Historia | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Namnursprung | Helios, den grekiska solguden.[11][12] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Upptäckt | Pierre Janssen, Norman Lockyer (1868) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Första isolation | William Ramsay, Per Teodor Cleve, Abraham Langlet (1895) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stabilaste isotoper | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Säkerhetsinformation | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Säkerhetsdatablad: Sigma-Aldrich | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| H-fraser | H280 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| P-fraser | P403 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S-fraser | S9, S23 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SI-enheter och STP används om inget annat anges. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Helium är det näst vanligaste grundämnet i universum. Nytt helium uppstår genom fusionsprocesser i stjärnorna och genom alfastrålning från radioaktiva grundämnen. Koncentrationen i jordens atmosfär är låg, så helium utvinns mest ur naturgas.
Helium används inom flera teknikområden: Eftersom gasen är lätt och inert med små obundna atomer passar den som kontrollerad atmosfär, vid läcksökning och som drivgas i raketer. Flytande helium är ett viktigt kylmedel inom lågtemperaturtekniken och i det supraflytande tillståndet blir ämnet en mycket god värmeledare.
Heliumatomen redigera
Heliumatomens kärna består av två protoner och en eller flera neutroner. Det omgivande elektronmolnet har två elektroner som fyller 1s-orbitalen. Av alla atomer har helium den minsta radien.[5]
Helium har två naturliga stabila isotoper med olika fysikaliska egenskaper vid låg temperatur, dessutom några instabila syntetiska isotoper.
Helium-4 redigera
Den på jorden helt övervägande isotopen Helium-4, eller 4He, har två neutroner och är en boson. Kärnan har en bindningsenergi av 7,07 Megaelektronvolt (MeV) per nukleon, vilket är det högsta värdet bland alla atomer med masstal under 12. 4He-kärnan är därmed mycket stabil.
Helium-3 redigera
Helium-3- eller 3He-atomen har endast en neutron och är därmed en fermion. På jorden är den sällsynt och utgör endast 1,34 ppm av luftens heliumatomer.[13]
Bindningsenergin per nukleon är 2,57 megaelektronvolt (MeV), vilket är jämförbart med det radioaktiva 3H (tritium).[5]
Helium-3 som fusionsbränsle redigera
Man har diskuterat om 3He kan användas som bränsle i fusionskraftverk, genom deuterium-helium3- och helium3-helium3-fusionerna:
2H + 3He → 4He + 1H
3He + 3He → 4He + 2 1H
Till skillnad från de i forskningsreaktorer vanligen använda DT och DD-processerna, skulle 3He-fusion ha fördelen att varken generera neutroner eller radioaktiva isotoper. De reaktortekniska extra-svårigheterna för 3He-fusion är dock betydande: Deuteriumkärnor fusionerar lättare med varandra än med 3He och för att fusionera två 3He-kärnor behövs mycket högre temperaturer och tryck än för DT- och DD-Processerna.[14]
Syntetiska isotoper redigera
De radioaktiva isotoperna
- 6He, med halveringstiden 805 ms och
- 8He, med halveringstiden 122 ms
förekommer inte naturligt och övergår vanligen till litium genom betasönderfall.[15]
Aggregationstillståndens egenskaper redigera
På grund av heliums speciella egenskaper behandlas i följande avsnitt suprafluiditet som ett aggregationstillstånd även om detta inte stämmer exakt med gängse allmän definition
Till skillnad från de flesta andra grundämnen beror övergångarna mellan heliums aggregationstillstånd starkt av isotopen.
| Egenskap | 4He | 3He |
|---|---|---|
| Kritiskt tryck[5] | 229 kPa | 124 kPa |
| Kritisk temperatur[5] | 5,20 K | 3,37 K |
| Kokpunkt vid atmosfärstryck[5] | 4,215 K | 3,191 K |
| Övergång till suprafluiditet (atmosfärstryck)[16] | 2,17 K | 1 mK |
Gasform redigera
Vid 0 °C och 1000 kPa är helium en färglös gas utan lukt och smak. Densiteten är 0,178 kg/m3, eller knappt en sjundedel av luftens. En heliumballong med volymen 1 m3 lyfter 1,115 kg, inklusive sin egen massa. Den låga densiteten inverkar även på ljudhastigheten, som är 971 m/s, eller knappt 3 gånger ljudhastigheten i luft.[5]
Heliums värmeledningsförmåga är 0,142 W/(m*K) vid 19 °C, eller fem gånger luftens.[5]
Heliumatomen, som är mindre än alla gas-atomer och -molekyler,[5] diffunderar särskilt lätt genom små öppningar.
Flytande helium redigera
Vid temperaturer under 4 K (−269 °C) kondenserar helium till en färglös vätska. Flytande helium har flera speciella egenskaper:
- Kokpunkten är den lägsta av alla grundämnen. Alla andra grundämnen har en kokpunkt över 20 K.[5]
- Vid atmosfärstryck är helium (supra-)flytande vid absoluta nollpunkten. Alla andra grundämnen är fasta vid 10 K.[5]
Supraflytande helium redigera
Supraflytande 4He redigera
Vid lambdapunkten, 2,17 K, övergår 4He i en supraflytande fas utan viskositet. Vätskan kan flyta genom kapillärer utan mätbar friktion[17] och den kan flyta över barriärer till en lägre potential. Genom den andra ljudvågen får vätskan en mycket hög värmeledningsförmåga.
I litteratur kallas ofta den "vanligt" flytande fasen i 4He för helium I. Den supraflytande fasen kallas helium II.[18]
Det finns flera teorier om suprafluiditet i 4He:
- Fritz London antog att 4He nära absoluta nollpunkten blir ett Bose–Einstein-kondensat.
- László Tiszas två-vätske-modell uppfattar helium under lambdapunkten som en blandning av en normalt flytande och en supraflytande fas.
- Lev Landau införde en ny kvasipartikel: Rotonen för att beskriva supraledningen i 4He
Supraflytande 3He redigera
Vid temperaturer under 1 mK kan även 3He bli supraflytande. Supraflytande 3He har en mer komplicerad struktur än 4He och måste förklaras med andra teorier.[19]
Helium i fast form redigera
Endast vid låga temperaturer och tryck högre än 2,5 MPa, (cirka 25 atmosfärer), kan helium inta fast form. Kristallstrukturen är hexagonal (hcp) eller i vissa fall kubiskt rymdcentrerat (bcc).
Trippelpunkt redigera
Fast helium sublimeras inte till gasform. Det finns därmed ingen trippelpunkt enligt gängse definition. Som trippelpunkt kan man istället ange jämviktspunkten mellan faserna "gas", "flytande" och "supraflytande" (för 4He: 2,172 K och 5,035 kPa) eller den mellan faserna "flytande", "supraflytande" och "fast" (för 4He: 1,76 K och 3,02 MPa). Dessa motsvarar lambdapunktens lägsta och högsta tryck.[20]
Kemiska egenskaper redigera
Molekyler och joner redigera
På grund av elektronstrukturen och elektronernas närhet till kärnan är helium inert. Med 24,6 eV är joniseringsenergin den högsta av alla atomers.[5] Helium ingår därför endast i specialfall molekyl- eller jon-liknande förbindelser.
Dihelium redigera
Dihelium (He2, ChEBI ID:33685[21]) är en mycket löst bunden dimer som uppstår genom van der Waals-kraft. I dimeren är avståndet mellan atomerna hela 5,2 nm och bindningsenergin 1,1 mK [22] (10-7eV). Eftersom vibrationsenergi lätt bryter upp molekylen är den instabil, utom vid temperaturer nära absoluta nollpunkten. Dihelium kan joniseras och den negativa jonen He2- är metastabil med livslängd över 1 μs.[23]
Litium-Helium dimer redigera
Man har vid temperaturer under 5K även kunnat påvisa en van der Waals-dimer av helium och litium (LiHe).[24]
Löslighet redigera
Heliums vattenlöslighet är mycket låg: Endast 1.5 mg helium kan lösas i en liter vatten vid 20 °C och 1013 hPa.[25][10]
Förekomst redigera
I universum redigera
I universum är helium det näst vanligaste grundämnet:[25] Enligt Big Bang-teorin skedde en tidig nukleosyntes av lätta atomkärnor inom 20 minuter efter Big Bang. Efter denna skall 25 % av universums massa ha bestått av 4He och 10 ppm av 3He. Heliumhalten stämmer ungefär med vad som idag observeras i utomgalaktiska H II-regioner.[26][27]
Solen och solsystemet redigera
Helium är också vanligt i solsystemet: solens, liksom många andra stjärnors, värme uppstår huvudsakligen genom proton-proton-processen där helium bildas ur väte. Solens fotosfär innehåller 25 % helium[28] och heliumhalten i solvinden är någon viktprocent av vätehalten.[29] I solvinden är mol-förhållandet mellan 3He och 4He ca. 430 ppm.[30]
Planeternas atmosfär har olika heliumkoncentration. Allmänt sett är den större i stora planeter:
| Venus | 0,0012 % (12 ppm)[31] |
| Jorden | 0,00052 % (5,2 ppm)[32] |
| Mars | mycket låg / okänd[33] |
| Jupiter | 10,2 %[34] |
| Saturnus | 3,25 %[35] |
| Uranus | 15,2 % ± 3,3 %[36] |
| Neptunus | 19 % ± 3,2 %[37] |
Tabell: Volymmässig heliumkoncentration i solsystemets planetatmosfärer.
Månytans regolit, som utsätts för solvinden, innehåller också helium. Förhållandet mellan de stabila isotoperna [3He]/[4He] är 0,03 viktprocent, liknande förhållandet i solvinden och betydligt högre än på jorden.[29]
På jorden redigera
I jordens innandöme bildas helium vid alfasönderfall av tunga grundämnen.[38] Naturgas kan därför innehålla ett par procent helium. Heliumrik naturgas finns normalt över kristallina bergarter innehållande uran eller torium. För att helium skall hållas kvar i ett lagerställe måste det vara täckt av täta sedimentära bergarter. Kväve fungerar som bärgas för heliumtransport i berget.[39] I vår atmosfär är heliumkoncentrationen dock endast 5,2 ppm[32] eftersom heliumatomerna snabbt avges till världsrymden.
Produktion och marknad redigera
Anrikningsprocess redigera
Naturgasen ur vilken helium utvinns bör ha en halt av minst 0,4 %. Den genomgår först en förbehandling där koldioxid, vattenånga och tyngre kolväten tas bort. Därefter avskiljs metan och kväve i flera steg genom fraktionerad destillation. Produkten är ett råhelium med 50 till 70 % helium, kvävgas liksom små mängder metan, vätgas och neon. Råhelium renas genom kondensation av kvävgas och metan, oxidering av vätet och pressure-swing-adsorption (PSA) till 99,99 % renhet.[40]
Tillgång redigera
Världens heliumutvinning år 2016 uppskattas till 132 miljoner m³. Marknaden domineras av USA och Qatar:
- 2016 producerade USA 63 miljoner m³ helium.[41] Produktionen kommer ur källor i norra Texas, Oklahoma, Kansas och östra Colorado men också längre västerut, runt Klippiga bergen.[42] Dessutom frigjordes 22 miljoner m³ helium ur den statliga strategiska reserven (National Helium Reserve) i Cliffside utanför Amarillo, Texas.
- Qatars helium anrikas i Ras Laffan.[43] 2016 producerades 50 miljoner m³.
- Algeriet var världens tredje största producent med 10 miljoner m³.[41]
Produktion i EU redigera
Inom Europeiska unionens område finns helium i sydvästra Polen. År 2015 utvanns där 1 miljon m³ ur naturgasresevoarer med en heliumhalt om 0,22 till 0,42 %.[44] En produktionsenhet står i Odolanow.[45]
Pris och trender redigera
En kubikmeter helium med 99,997 % renhet, Helium-A, handlades 2016 för 7,21 US dollar.[41] Priset från USA:s strategiska reserv styrs av Helium Privatisation Act från 1996.[42]
I takt med att naturgas förbrukas som bränsle, utan att ta vara på heliuminnehållet, minskar världens lätt utvinnbara heliumtillgångar. Det har spekulerats i heliumbrist om USA:s strategiska reserv skulle uttömmas, men år 2016 innehöll reserven 735 miljoner m³ vilket skulle räcka att upprätthålla nuvarande försäljning åtminstone i 30 år. Världens heliumresurser uppskattas till 52 miljarder m³.[41]
Användningsområden redigera
Kylmedium redigera
I USA går en tredjedel av heliumkonsumtionen till kylanvändningar. Flytande helium är ett viktigt kylmedium inom lågtemperaturtekniken och för att nå temperaturer under 17 K finns det knappast något alternativ.[46] I de flesta fall inträffar supraledning under 17 K så en vanlig användning är att kyla supraledande magneter, exempelvis i de medicinska undersökningsmetoderna magnetisk resonanstomografi (MRI), kärnmagnetisk resonans (NMR) och elektronspinnresonans.[47][48]
Supraflytande helium vid 1,9 K har en värmeledningsförmåga mer än hundra gånger högre än syrefri (OF-)koppar och är därmed en mycket effektiv värmeledare.[49]
Tryck och rensning redigera
Stora mängder helium används i raketer för att trycksätta och rensa tankar med kalla vätskor, exempelvis flytande syre.[50]
Kontrollerad atmosfär redigera
Reaktionströghet, lätthet och god värmeledningsförmåga gör heliumgas till en lämplig omgivning vid metallurgiska processer, liksom tillverkning av halvledare och optisk fiber.[50] Den används även som rörlig fas i gaskromatografi och som förpackningsgas för livsmedel (E-nummer E 939).
Skyddsgas vid metallbearbetning redigera
Helium används även vid svetsning: Eftersom den är inert hindrar den, om den utledes över svetsskarven, luftens syres skadliga oxidering av smältan. Här kan helium dock ofta ersättas med argon.[50][41]
Läcksökning redigera
Heliumatomerna utgör mycket små partiklar som lätt diffunderar genom öppningar. Den lättflyktiga gasen används därför gärna vid läcksökning i vakuumkärl och bränslesystem.[50]
Andningsgasblandningar redigera
En mindre del av världens heliumförbrukning går till helium-syrgas-blandningar. De används medicinskt, vid spirometri[47] och för att lindra symptom vid lungsjukdomar men även som andningsgas vid dykning (Heliox) för att minska kvävenarkosen. En nackdel med helium vid dykning är den höga värmeledningsförmågan som kan kyla kroppen.[51]
Den höga ljudhastigheten skapar det berömda fenomenet Kalle Anka-röst som människor får när de inhalerar helium-syre-blandningar. Varning: Inandning av rent helium bör aldrig ske på grund av att syremättningen i blodet sjunker blixtsnabbt och det är stor risk för att man förlorar medvetandet, och det finns risk för att man dör eller får hjärnskador av syrebrist.
Andra användningar redigera
Helium används sedan länge i gasballonger och luftskepp eftersom den billigare och lättare vätgasen medför eldfara och explosionsrisk. Helium används även inom belysningsteknik och i Helium-Neon-lasern.
Risker och säkerhet redigera
Neutralt helium vid normala förhållanden är inte giftig, spelar ingen biologisk roll och hittas i mycket små mängder i människans blod. Om stora mängder helium inandas, kan syret som behövs för normal andning ersättas, och kvävning inträffa.
Säkerhetsfrågorna för helium med en låg temperatur liknar dem för flytande kväve. Dess extremt låga temperatur kan resultera i köldskador, vilka blir allvarligare med sprej än vid kontakt med vätska. I det senare fallet bildas ett så kallat Leidenfrost-skikt mot huden, som tillfälligt hindrar direktkontakten. Vidare kan omvandlingen från vätska till gas orsaka explosioner, om inte någon tryckkammare är installerad.
Containrar med helium i gasform vid runt -265 °C ska hanteras som om de innehöll flytande helium, på grund av den snabba och betydande utvidgningen som uppstår, när helium i gasform under -265 °C värms till rumstemperatur.
Historia redigera
Vid en solförmörkelse 1868 upptäckte fransmannen Jules Janssen spektrallinjer i solens spektrum, som inte tillhörde något känt atomslag, varför engelsmannen Norman Lockyer antog att de kom från ett hittills okänt grundämne som sedan han och den engelske astronomen Edward Frankland kallade helium (efter grekiska ἥλιος [hêlios] - solen). År 1895 framställde den engelske kemisten William Ramsay helium genom att lösa ett uranhaltigt mineral i syra, vilket identifierades av Lockyer och Frankland som helium och samma år detekterade den tyske fysikern Heinrich Kayser spektrallinjer från helium i en ädelgasblandning framställd ur luft. Samma år framställde engelsmannen N.A. Langley och oberoende de svenska kemisterna Per Teodor Cleve och Abraham Langlet helium med exakt samma metod. År 1905 upptäcktes att naturgas från en källa i Dexter, Kansas innehöll 2 % helium[40] och 1909 visade Ernest Rutherford och Thomas Royds att alfapartiklar var heliumkärnor.[52]
Helium var den sista av gaserna som man lyckades överföra i vätskeform. Det såg till och med ut som om helium kanske var den enda egentliga gasen, det vill säga okondenserbar till skillnad från ångor enligt gammal definition. Genom att utnyttja den temperatursänkning som erhålls när en komprimerad gas utvecklar arbete i en detander(dekompressor) lyckades holländaren Heike Kamerlingh Onnes år 1908 få helium att undan för undan, med hjälp av välkonstruerade värmeväxlare kallna alltmer och till slut kondensera. Just detta renderade honom 1913 års nobelpris i fysik.[53]
Med kokande helium som köldmedium kunde metallernas resistivitet vid mycket låga temperaturer studeras. Av speciellt intresse var dåtidens resistansnormal kvicksilver. Kamerlingh Onnes fann år 1911 att resistiviteten hos just kvicksilver vid 4,2 K, det vill säga helt nära heliums kokpunkt vid normalt atmosfärstryck, försvann på ett abrupt och helt oväntat sätt (se supraledning).
Under första världskriget blev helium, som inert fyllgas i luftskepp och spärrballonger, militärt viktigt. 1925 antog USA Helium Act som förbjöd försäljning till icke-statliga ändamål. Denna reglering lättades först efter Hindenburgkatastrofen 1937.[40]
Redan Kamerlingh Onnes beskrev att något speciellt hände i flytande helium vid 2 K men upptäckten av suprafluiditet under 1930-talet brukar tillerkännas Pjotr Kapitsa.[18]
År 1937 blev USA:s heliumproduktion i praktiken ett statligt monopol. Under 1950-talet spekulerade man i att helium skulle bli en viktig resurs i det kalla kriget och 1960 antogs ett tillägg till Helium Act som lät inrikesdepartementet lagra överskott i en nationell reserv i den delvis tömda gaskällan Bush Dome Reservoir i Cliffside nära Amarillo i Texas, och dessutom låna federala medel för att köpa helium från privata producenter. Man tecknade 22-åriga köpekontrakt och snart öppnades privata anläggningar för heliumutvinning. När produktionen så mångdubblades medan konsumtionen endast steg marginellt, tillfördes Cliffside under tiden 1964 till 1972 årligen mer än ⅔ av USA:s heliumproduktion. 1973 hade USA byggt upp en överdimensionerad nationell reserv om 970 Mm³ råhelium till stora kostnader. Regeringen bröt köpekontrakten, vilket ledde till drastiskt minskad produktion och långvariga rättsprocesser.[42]
Suprafluiditet i 3He upptäcktes i början av 1970-talet av Lee, Richardson och Osheroff[19]
Efter 1975 steg heliumkonsumtionen snabbare och under 1980-talet förbättrades lönsamheten hos USA:s privata utvinnare.
År 2006 producerade USA 90% av världens helium.[54] Med lagen Helium Privatisation Act från detta år blev USA:s heliumproduktion helt privat och de federala källorna lades i malpåse.[42] De följande åren ökade Algeriets produktion och 2005 började Qatar anrika stora mängder[43].
Eftersom den sällsynta 3He-isotopen kan ha värde som fusionsbränsle har man sedan 2004 spekulerat i möjligheten att utvinna 3He ur månytan för att lösa jordens energibehov.[14][55][56]
Se även redigera
Noter redigera
- ^ Michael E. Wieser und Tyler B. Coplen: Atomic weights of the elements (IUPAC Technical Report) In: Pure and Applied Chemistry Vol. 83, No. 2, 2011, S. 359–396.
- ^ IUPAC, Standard Atomic Weights Revised 2013.
- ^ ”Helium”. GESTIS. IFA, Institut für Arbeiterschutz der Deutschen Gesetzlichen Unfallversicherung. Arkiverad från originalet den 13 november 2015. https://web.archive.org/web/20151113104703/http://gestis.itrust.de/nxt/gateway.dll/gestis_de/000000.xml?f=templates%24fn%3Ddefault.htm%243.0. Läst 2 november 2015.
- ^ Helium i substansdatabasen GESTIS-Stoffdatenbank hos IFA (Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung). Läst 12 juli 2009. (JavaScript krävs)
- ^ [a b c d e f g h i j k l m] Carl Nordling & Jonny Österman (1983). Physics Handbook. Studentlitteraur. ISBN 91-44-16572-2
- ^ Shuen-Chen Hwang, Robert D. Lein, Daniel A. Morgan (2005). "Noble Gases". Kirk Othmer Encyclopedia of Chemical Technology. Wiley. pp. 343–383. doi:10.1002/0471238961.0701190508230114.a01.
- ^ L. C. Allen, J. E. Huheey: The definition of electronegativity and the chemistry of the noble gases.
- ^ Magnetic susceptibility of the elements and inorganic compounds Arkiverad 12 januari 2012 hämtat från the Wayback Machine., in Handbook of Chemistry and Physics 81st edition, CRC press.
- ^ R. E. Glick: On the Diamagnetic Susceptibility of Gases. I: J. Phys. Chem. 1961, 65, 9, S. 1552–1555, doi:10.1021/j100905a020.
- ^ [a b c] ”Säkerhetsdatablad Helium, Helium-061A-SE, 2014-07-10”. Air Liquide. http://alsafetydatasheets.com/download/se/Helium_komprimerad_SE.pdf. Läst 2 november 2015.
- ^ Royal Society of Chemistry – Visual Element Periodic Table
- ^ – Online Etymological Dictionary
- ^ Berglund & Wieser (2011). ”Isotopic compositions of the elements 2009”. IUPAC, Pure and Applied Chemistry 83 (2): sid. 399 (Table 1). https://www.iupac.org/publications/pac/pdf/2011/pdf/8302x0397.pdf. Läst 18 december 2016.
- ^ [a b] Mark Williams (2007). ”Energie vom Mond”. Technology Review [På tyska] (31 Augusti). http://www.heise.de/tr/artikel/Energie-vom-Mond-280259.html. Läst 25 april 2015.
- ^ Chart of the nuclides, bilaga till Physics Handbook, 2 upplagan. Knolls Atomic Power Laboratory. 12th edition, 1977. ISBN 91-44-16572-2
- ^ Thuneberg, Erkki. ”Helium”. http://ltl.tkk.fi/research/theory/helium.html. Läst 3 april 2015.
- ^ Smith & Höjgaard Jensen (1989). Transport Phenomena. Clarendon Press, Oxford. sid. 354. ISBN 0-19-851985-0. http://books.google.ca/books?id=xPt9AAAAIAAJ&pg=PA354&hl=sv&source=gbs_toc_r&cad=3#v=onepage&q&f=false
- ^ [a b] Kungliga Vetenskapsakademin (1978-10-17). ”The Nobel Prize in Physics 1978”. Pressmeddelande. Läst 3 april 2015.
- ^ [a b] Kungliga Vetenskapsakademin (1996-10-09). ”Nobelpriset i fysik 1996”. Pressmeddelande. Läst 3 april 2015.
- ^ ”Superfluid Helium - What is it”. Arkiverad från originalet den 5 april 2007. https://web.archive.org/web/20070405010647/http://www.fluidmech.net/msc/super/super-f.htm. Läst 1 november 2015.
- ^ ”dihelium”. Chemical Entities of Biological Interest. https://www.ebi.ac.uk/chebi/searchId.do?chebiId=33685. Läst 5 december 2016.
- ^ Grisenti et al (September 11, 2000). ”Determination of the Bond Length and Binding Energy of the Helium Dimer by Diffraction from a Transmission Grating”. Physical Review Letters, Volume 85 85 (11): sid. 2284-2287. doi:. http://adsabs.harvard.edu/abs/2000PhRvL..85.2284G. Läst 5 december 2016.
- ^ Krishnamurthy & Mathur. ”An experimental and theoretical study of the negatively charged helium dimer, He2−”. Chemical Physics Letters 167 (5): sid. 475-478. doi:. http://www.sciencedirect.com/science/article/pii/000926149085034A. Läst 5 december 2016.
- ^ Bretislav Friedrich (8 april 2013). ”Viewpoint: A Fragile Union Between Li and He Atoms”. Physics. http://physics.aps.org/articles/v6/42#c4. Läst 6 december 2016.
- ^ [a b] ”Helium und Wasser”. Lenntech BV. http://www.lenntech.de/pse/wasser/helium/helium-und-wasser.htm. Läst 26 april 2015.
- ^ J. Beringer et al. Revised by K.A. Olive & J.A. Peacock (2012). ”21. Big Bang Cosmology”. Review of Particle Physics: sid. 21.3.7, p.18f. http://pdg.lbl.gov/2012/reviews/rpp2012-rev-bbang-cosmology.pdf. Läst 26 april 2015.
- ^ Wright, Edward L.. ”Big Bang Nucleosynthesis”. http://www.astro.ucla.edu/~wright/BBNS.html. Läst 26 april 2015.
- ^ ”The suns vital statistics”. Stanford Solar Center. http://solar-center.stanford.edu/vitalstats.html. Läst 21 april 2015.
- ^ [a b] Harrison H. Schmitt (2014). ”Synthesis of Current Data on Helium and Hydrogen Concentrations in Lunar Regolith”. Search and Discovery (American Association of Petroleum Geologists) (Artikel# 70162). http://www.searchanddiscovery.com/documents/2014/70162schmitt/ndx_schmitt. Läst 25 april 2015.
- ^ Solar wind helium, neon, and argon isotopic and elemental composition: Data from the metallic glass flown on NASA’s Genesis mission, Grimberg et al, Geochimica et Cosmochimica Acta 72 (2008) 626–645
- ^ NASA Factsheet Venus, läst 19 juli 2017
- ^ [a b] NASA Factsheet Earth, läst 19 juli 2017
- ^ NASA Factsheet Mars, läst 19 juli 2017
- ^ NASA Factsheet Jupiter, läst 19 juli 2017
- ^ NASA Factsheet Saturn, läst 19 juli 2017
- ^ NASA Factsheet Uranus, läst 19 juli 2017
- ^ NASA Factsheet Neptune, läst 19 juli 2017
- ^ http://www.sciencedaily.com/releases/2008/01/080102093943.htm
- ^ ”The Atmosphere”. Inter-American Corporation. Arkiverad från originalet den 22 augusti 2015. https://web.archive.org/web/20150822150316/http://www.helium-corp.com/facts/heliumfound.html. Läst 23 augusti 2015.
- ^ [a b c] Cris Cavette. ”How helium is made”. How products are made. http://www.madehow.com/Volume-4/Helium.html. Läst 19 april 2015.
- ^ [a b c d e] John E. Hamak (Januari 2017). ”Helium”. U.S. Geological Survey, Mineral Commodity Summaries. https://minerals.usgs.gov/minerals/pubs/commodity/helium/mcs-2017-heliu.pdf. Läst 10 juni 2017.
- ^ [a b c d] The Impact of Selling the Federal Helium Reserve ISBN 0-309-07038-4, National Academies Press, Washington D.C., 2000
- ^ [a b] Chemicals Techology.com; Qatar Helium II Refining Facility, Ras Laffan Industrial City, Qatar
- ^ ”Helium, Mineral resources 2015”. Polska geologiska institutet (Państwowy Instytut Geologiczny). http://geoportal.pgi.gov.pl/surowce/energetyczne/hel/2015. Läst 1o juni 2017.
- ^ ”Odolanow, Poland”. Inter-American Corporation. Arkiverad från originalet den 16 januari 2015. https://web.archive.org/web/20150116215822/http://www.helium-corp.com/worldproduction/odolanow.html. Läst 19 april 2015.
- ^ John E. Hamak (Januari 2016). ”Helium”. U.S. Geological Survey, Mineral Commodity Summaries. https://minerals.usgs.gov/minerals/pubs/commodity/helium/mcs-2016-heliu.pdf. Läst 10 juni 2017.
- ^ [a b] ”Vad du bör veta om gas på sjukhus”. AGA / Linde Gas Therapeutics. Arkiverad från originalet den 14 oktober 2015. https://web.archive.org/web/20151014014256/http://www.agalindehomecare.se/international/web/lg/se/like35lglgtse.nsf/repositorybyalias/gas_pa_sjukhus/%24file/Vad_du_bor_veta_2008.pdf. Läst 26 april 2015.
- ^ ”Helium applications”. Air Liquide. Arkiverad från originalet den 22 mars 2014. https://web.archive.org/web/20140322112952/http://www.airliquide.com/en/company/our-businesses-our-products/other-gases/helium-3/helium-applications.html. Läst 28 april 2015.
- ^ Lebrun, Philippe (1997). Superfluid Helium as a Technical Coolant. CERN, LHC Project Report No. 125. sid. 4. http://cds.cern.ch/record/330851/files/lhc-project-report-125.pdf
- ^ [a b c d] King, Hobart. ”Helium: A byproduct of the natural gas industry”. Geology.com. http://geology.com/articles/helium/. Läst 27 april 2015.
- ^ Roxlau, Rüdiger. ”Technical Diving - Argon (på tyska)”. http://www.rrsystems.de/tauchen/technical_diving/argon.htm. Läst 28 april 2015.
- ^ Ernest Rutherford und T. Royds: The Nature of the α Particle from Radioactive Substances. Phil. Mag. 17, 281-6 (1909) Online
- ^ Nordström. ”Nobel Prize in Physics 1913 - Presentation Speech, Kamerlingh Onnes.”. Nobel Media AB. https://www.nobelprize.org/prizes/physics/1913/ceremony-speech/. Läst 3 april 2015.
- ^ U.S. Geological Survey, Mineral Commodity Summaries, January 1998, Joseph B. Peterson
- ^ Harrison H. Schmitt (2004). ”Mining the Moon”. Popular Mechanics (October): sid. 56-63. http://www.searchanddiscovery.com/documents/2004/schmitt/images/schmitt.pdf. Läst 25 april 2015.
- ^ Could Helium-3 really solve Earth's energy problems?, Keith Veronese.
Externa länkar redigera
- Wikimedia Commons har media som rör Helium.

