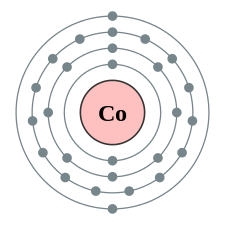
Kobolt
Kobolt är ett hårt, silvergrått, metalliskt grundämne med kemiskt tecken Co. Kobolt är ferromagnetiskt med en curietemperatur på 1 388 K (1 115 °C).
Historia redigera
Det tyska namnet Kobalt användes under medeltiden för vissa malmer som inte gav metaller, utan endast giftiga ångor vid reduktion. De ansågs vara förtrollade av bergtroll, så kallade kobolder,[9] ett väsen man förr trodde bodde i underjorden och kunde påverka malmen i gruvor.[10]
Den svenske kemisten Georg Brandt isolerade kobolt på 1730-talet och visade att det är kobolt som ger den blå färgen i smalt, det pigment som länge använts bland annat för att blåfärga glas och glasyr. Tidigare trodde man att det kom från vismut.
Toxicitet redigera
Det är ovanligt med koboltförgiftningar, men förekommer vid exponering av högre doser. Flera system i kroppen kan då påverkas, däribland hjärta och lungor.[11] Kobolt kan även vara cancerframkallande vid hög exponering.[12][13]
Användningsområden redigera
Metallindustri redigera
Kobolt förekommer i olika legeringar för att ge ökad brottstyrka, motstånd mot syreangrepp eller av dess magnetiska egenskaper. En vanlig legering är magnetiska alnico som bland annat används till magnet för mikrofoner och högtalare.
Kobolt används ofta i litiumjonbatterier, uppladdningsbara batterier där litiumkoboltoxid är vanligt som aktivt material i den positiva polen.[14] Inte minst den ökande tillverkningen av elbilar bidrar till en allt större efterfrågan på kobolt, och billigare alternativ söks.[15][16]
Hårdmetall redigera
Kobolt är det vanligast förekommande ämnet att användas som bindefas, då det tillsammans med volframkarbid bildar hårdmetall.[17][18]
Strålkälla redigera
Isotopen kobolt-60 är en kraftig strålkälla (gammastrålning) som kan användas för cancerbehandling, sterilisering av sjukhusutrustning och livsmedel, materialprovning med mera. Denna isotop kan framställas genom att bestråla "normalt" stabilt kobolt-59 med neutroner. Traditionellt har detta skett i forskningsreaktorer, men på grund av en åldrande flotta av dessa har det på senare tid (2010) även börjat utföras som en sidoprocess i kraftproducerande reaktorer.[19] Särskilda behållare med kobolt-59 förs in i härden, och kan efter en viss tid tas ut och tömmas på omvandlat kobolt-60.
Oönskad förekomst i kärnkraftverk redigera
Processen att stabilt kobolt-59 omvandlas till radioaktivt kobolt-60 sker även oönskat i kärnkraftverk, då fragment av kobolthaltiga komponenter (till exempel ventilers glidytor) kan nötas av eller kemiskt lösas ut och följa med in i reaktorn. Framförallt för kokvattenreaktorer (BWR) har detta visat sig kunna bli en dominerande källa till stråldoser till personal, och stora ansträngningar har gjorts för att hitta ersättningsmaterial med lägre halter av kobolt, samt att anpassa kemi-parametrar i processen för att minska upplösning och transport av kobolt.[20]
Halveringstiden för kobolt-60 är cirka 5 år, vilket gör att stråldosen redan efter några decennier minskat till bråkdelar av den ursprungliga och ger helt försumbara dosbidrag i längre tidsperspektiv.
Färgpigment redigera
Kobolt används i flera pigment, däribland koboltblått. Fram till 1900-talet var kobolts största användningsområde framställning av smalt, ett blått pigment för såväl målningsfärger som för glas och keramik.[21]
Vitamin B12 redigera
Vitaminet B12 har fått sitt namn kobalamin efter kobolt som utgör en central atom i dess sammansättning.[10] Vitamin B12 är nödvändigt för kroppens produktion av röda blodkroppar och bildandet av myelin som bidrar till nervsystemets funktion.
Kärnvapen redigera
Teoretiskt kan kobolt tillsättas kärnvapen för att utöka den radioaktiva verkan. I en sådan så kallad koboltbomb utsätts kobolt vid detonation för strålning som gör det radioaktivt med lång halveringstid.
Förekomst redigera
Kobolt förekommer i mineralen koboltglans, smaltit och erytrit.
Kobolt i Sverige redigera
Tidigare har kobolt brutits i Los koboltgruva i Hälsingland och Vena koboltgruvor i Närke.[22] Andra platser för brytning av koboltmineral var Gladhammar, Tunaberg, Håkansboda (i Västmanland) och Riddarhyttan.[23]
Möjliga nya förekomster finns i Ahmavuoma, som ligger mellan Lannavaara och Lainio, nära Vittangi[24][25] och i Oviken i Bergs kommun.[26]
Se även redigera
Källor redigera
- ^ ”CIAAW, Standard Atomic Weights Revised 2019”. IUPAC. https://www.ciaaw.org/atomic-weights.htm. Läst 18 februari 2021.
- ^ J.D. Donaldson, D. Beyersmann: Cobalt and Cobalt Compounds in Ullmann's Encyclopedia of Industrial Chemistry, 2005 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, doi:10.1002/14356007.a07_281.pub2.
- ^ Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. I: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- ^ Harry H. Binder: Lexikon der chemischen Elemente, S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- ^ Ludwig Bergmann, Clemens Schaefer, Rainer Kassing: Lehrbuch der Experimentalphysik, Band 6: Festkörper. 2. Auflage, Walter de Gruyter, 2005, ISBN 978-3-11-017485-4, S. 361.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd). Butterworth-Heinemann. sid. 1117–1119. ISBN 0-08-037941-9
- ^ Royal Society of Chemistry – Visual Element Periodic Table
- ^ – Online Etymological Dictionary
- ^ Anders Lennartsson, Periodiska systemet, Studentlitteratur, 2011
- ^ [a b] ”Södermanland, Kobolt - Co” (pdf). Kungliga vetenskapsakademien. Arkiverad från originalet den 11 augusti 2010. https://web.archive.org/web/20100811060652/http://www.landskapsgrundamnen.se/utskrift/sodermanl.pdf. Läst 23 november 2009.
- ^ Irfan Sheikh: Cobalt Poisoning: A Comprehensive Review of the Literature Med Toxicol Clin Forens Med. 2016,2:2. Läst 9 april 2018.
- ^ Cobalt and Cobalt Compounds i: lARe Monographs on the Evaluation of Carcinogenic Risks to Humans : Volume 52 (1991), WHO. Läst 10 april 2018.
- ^ Metallic Cobalt Particles (with or without Tungsten Carbide) : Summary of Data Reported and Evaluation i: lARe Monographs on the Evaluation of Carcinogenic Risks to Humans : Volume 86 (2006), WHO. Läst 10 april 2018.
- ^ Batteriets historia, Batteriföreningen. Läst 13 mars 2021.
- ^ Litium-jon-batterier Arkiverad 23 januari 2022 hämtat från the Wayback Machine., Institutionen för kemi - Ångström, Uppsala universitet. Läst 13 mars 2021.
- ^ Chengjian Xu et al. Future material demand for automotive lithium-based batteries, Communications Materials, 2020. Läst 13 mars 2021.
- ^ Pulvermetallurgi, Björn Uhrenius, Läromedel KTH, (2000), Läst 13 februari 2015
- ^ ”Material i arbetsstycket”. Sandvik Coromant. https://www.sandvik.coromant.com/sv-se/knowledge/materials/pages/workpiece-materials.aspx. Läst 17 september 2021.
- ^ ”Clinton's cobalt campaign”. WNN - World Nuclear News. 20 januari 2010. http://www.world-nuclear-news.org/RS_Clintons_cobalt_campaign_2001102.html. Läst 20 juli 2018.
- ^ Daniel M. Wells (2011). ”Cobalt Reduction Sourcebook”. EPRI - Electric Power Research Institute. http://www.isoe-network.net/publications/pub-proceedings/symposia/north-american-tc-symposia/fort-lauderdale-usa-january-2011/slides-14/session-vi-1/1752-wells2011-ppt/file.html. Läst 20 juli 2018.
- ^ ”NE - Smalt”. Nationalencyklopedin. http://www.ne.se/smalts. Läst 23 november 2009.
- ^ Enghag, Per (1998). Jordens grundämnen och deras upptäckt, del 1. Några viktiga teknikmetaller. Stockholm: Industrilitteratur. sid. 218–230. ISBN 91-7548-511-7
- ^ "Kobolt", Nordisk familjebok, tredje upplagan, band 11, spalt 928, 1929
- ^ ”Drömmen om nya gruvor i Nya Socialdemokraten den 26 juni 2017”. Arkiverad från originalet den 7 januari 2018. https://web.archive.org/web/20180107034852/http://www.nsd.se/nyheter/drommen-om-nya-gruvor-nm4580669.aspx. Läst 16 december 2017.
- ^ ”Talga mining vill undersöka Ahmavuoma i Norrländska Socialdemokraten den 15 maj 2017”. Arkiverad från originalet den 19 maj 2017. https://web.archive.org/web/20170519153640/http://www.nsd.se/nyheter/talga-mining-vill-undersoka-ahmavuoma-nm4544038.aspx. Läst 16 december 2017.
- ^ ”Nu startar kampen mot gruvbrytning i Oviken på www.metallerochgruvor.se den 4 maj 2016”. Arkiverad från originalet den 17 december 2017. https://web.archive.org/web/20171217014911/http://www.metallerochgruvor.se/20170504/4370/nu-startar-kampen-mot-gruvbrytning-i-ortviken?page=2. Läst 16 december 2017.