Enzym
Enzymer är proteiner som katalyserar, alltså ökar eller minskar hastigheten på kemiska reaktioner.[1][2] I enzymatiska reaktioner kallas molekylerna som går in i reaktionen för substrat, vilket sedan omvandlas till andra molekyler kallade produkter. Nästan alla processer inom den biologiska cellen behöver enzymer för att fortgå med tillräckliga hastigheter. Varje enzym binder sina särskilda substrat till sitt aktiva centrum, den del av enzymet där själva katalyseringen av den kemiska reaktionen sker. I kombination med att ett enzym bara påskyndar ett fåtal reaktioner innebär detta att en cells metabolism i hög grad styrs av vilka enzym cellen producerar.
Liksom alla katalytiska molekyler fungerar enzymer genom att sänka aktiveringsenergin (Ea‡) för en reaktion. Detta resulterar i att produkterna bildas snabbare och att reaktionerna når sitt jämviktsstadium snabbare. De flesta enzymreaktioner går miljontals gånger snabbare än jämförbara okatalyserade reaktioner. Precis som med alla andra katalytiska molekyler konsumeras dessutom inte enzymer i reaktionerna de katalyserar, inte heller ändrar de reaktionernas jämvikt. Däremot skiljer sig enzymer från övriga katalytiska molekyler genom att de är mycket mer specifika. Man känner till över 4 000 biokemiska reaktioner som katalyseras av enzymer.[3] Ett fåtal RNA-molekyler kan också katalysera reaktioner och kallas då ribozymer. Ribozymerna upptäcktes på 1980-talet och utgör en vital del av ribosomen.[4][5] Syntetiska molekyler som kallas artificiella enzym uppvisar också enzymliknande katalytiska egenskaper.[6]
Enzymets aktivitet kan påverkas av andra molekyler. Inhibitorer är molekyler som minskar enzymaktivitet; aktivatorer är molekyler som ökar den. Många läkemedel och gifter är enzyminhibitorer. Aktiviteten påverkas också av temperatur, kemisk miljö exempelvis pH och koncentrationen av substrat. Vissa enzym används kommersiellt, i exempelvis framställning av antibiotika och andra läkemedel eller i tvättmedel , där enzymerna underlättar nedbrytningen av protein- eller fettfläckar på tvätten.
Redan i slutet av 1700-talet och början av 1800-talet var det känt att kött bröts ned av magsafter[7] samt att stärkelse omvandlades till socker av växtextrakt och saliv. Mekanismen för hur detta gick till var dock ännu inte identifierad.[8]
På 1800-talet, när Louis Pasteur studerade hur jäst kunde omvandla socker till alkohol, kom han fram till slutsatsen att jäsningen katalyserades av cellens livskraft, något som ansågs specifikt för levande organismer. Han skrev att "alkoholjäsning är korrelerad med jästcellernas liv och ordning, inte med döden eller cellernas förruttnelse".[en 1][9]
Termen enzym för denna process introducerades 1877 av den tyske fysiologen Wilhelm Kühne (1837–1900). Ordet kommer från det grekiska ενζυμον.[10]
1897 publicerade Eduard Buchner sin första artikel om jästextrakt som helt saknade levande celler men som ändå kunde jäsa socker. Han hade gjort upptäckten under en serie experiment vid Berlins universitet.[11] Han namngav enzymet som kunde jäsa sackaros "zymas".[12] 1907 mottog Eduard Buchner Nobelpriset i kemi med motiveringen: "för hans biologiskkemiska efterforskningar och upptäckten av cellfri jäsning".[13]
Efter att ha visat att enzymer kunde fungera utanför levande celler var nästa steg att bestämma dess biokemiska natur. Många forskare hade tidigare lagt märke till att enzymatisk aktivitet var associerat med proteiner, men flertalet forskare argumenterade för att proteiner endast var bärare för riktiga enzymer och att proteiner i sig själva inte kunde katalysera reaktioner. 1926 visade dock James Sumner att enzymet ureas i sin helhet var ett protein och kristalliserade det. Han gjorde samma sak med enzymet katalas 1937. Slutsatsen att proteiner kan vara enzymer bevisades definitivt av John Northrop och Wendell Stanley som arbetade med matsmältningsenzymerna pepsin, trypsin och kymotrypsin. De tre forskarna belönades för sina upptäckter med 1946 års nobelpris i kemi.[14]
Upptäckten att enzymer kunde kristalliseras ledde småningom till att dess strukturer kunde bestämmas med hjälp av röntgenkristallografi. Det första enzym vars struktur klargjordes på detta sätt var lysozym, ett enzym som finns i tårar, saliv och äggvita och som bryter ner cellväggen hos vissa bakterier. Strukturen bestämdes av en grupp ledd av David Phillips och publicerades 1965.[15] Den högupplösta strukturen för lysozym blev startpunkten för bestämning av många fler enzymstrukturer och försök att förstå hur enzymer fungerar på atomnivå.
Struktur och mekanismer
redigeraEnzymer är oftast globulära proteiner och deras längd varierar från endast 62 aminosyror för 4-oxalokrotonat tautomeras, som består av en enda peptidkedja,[16] till en längd på över 2 500 aminosyror i fallet animalt fettsyrasyntas.[17]
Liksom alla protein är enzymer långa, linjära kedjor av aminosyror som veckats till 3-dimensionella strukturer. Varje unik aminosyrasekvens ger en specifik form med unika egenskaper. Enzymers funktion bestäms av deras 3-dimensionella struktur.[18] Trots detta är det svårt att förutsäga ett enzyms funktion utifrån dess struktur, en nöt man hittills inte lyckats knäcka.[19]
De flesta enzymer är mycket större än de substrat de verkar på, och endast en liten del av enzymet (runt 3-4 aminosyror) är direkt inblandade i katalysen.[20] Den del av enzymet som innehåller dessa katalytiska aminosyror, som binder substratet och sedan stabiliserar reaktionen kallas för det aktiva centrumet. Enzymer kan också ha delar som kan binda kofaktorer, vilka då är nödvändiga för katalys. Vissa enzym har även bindningsplatser för små molekyler, vilka ofta är direkta eller indirekta produkter eller substrat i den reaktion enzymet katalyserar. Dessa bindningsställen kan bidra till att öka eller sänka enzymers aktivitet, och erbjuder på så sätt ett medel för negativ återkoppling.[21]
Proteinkedjor kan ibland gå ihop och ge upphov till proteinkomplex. De flesta enzymer kan denatureras, alltså vecklas upp och inaktiveras, av värme eller kemiska denaturanter, vilka förstör den 3-dimensionella strukturen hos proteinet. Beroende på enzymet kan denatureringen antingen vara reversibel eller irreversibel.[22]
Många enzymer tillverkas som fysiologiskt inaktiva proenzymer, även kallade zymogener, vilka ligger vilande i väntan på att bli aktiverade. Proenzymet aktiveras genom proteolytisk aktivering, då ett proteas klyver bort en del av proenzymet. Denna klyvning kan förändra enzymets form, men ofta har enzymets aktiva yta varit dold och blir fritt att binda sitt substrat i och med aktiveringen. En annan strategi för att hålla enzymer inaktiva tills de nått den plats där de ska agera, eller den tidpunkt då de behövs, är inhibitorer som binder enzymet och håller det inaktivt.[23]
Specificitet
redigeraEnzymer är oftast mycket specifika vad gäller vilka substrat de katalyserar i vilka reaktioner. Denna specificitet uppnås genom att utnyttja bland annat komplementär passform, elektrisk laddning och hydrofila/hydrofoba egenskaper hos enzymer och substrat. Enzymer kan också uppvisa mycket noggrann sterisk specificitet, regioselektivitet och kemoselektivitet.[24]
Några av de enzymer som visar högst specificitet och noggrannhet är involverade i replikerandet och uttryckandet av genomet, det vill säga proteinsyntesen. Dessa enzymer har korrekturläsningsmekanismer (på engelska: proof-reading). Exempelvis DNA-polymeras utför först katalysen i ett steg, och kontrollerar sedan i andra steget att produkten är korrekt.[25] Denna tvåstegsprocess resulterar i en genomsnittlig felfrekvens på mindre än ett fel per 100 miljarder reaktioner hos de noggrannare typerna av polymeras hos däggdjur.[26] Liknande korrekturläsningsmekanism finns även hos RNA-polymeraser,[27] aminoacyl-tRNA-syntetas[28] och ribosomer.[29]
"Nyckeln i låset"-modellen
redigeraEnzymer är mycket specifika. Nobelpristagaren och organkemisten Hermann Emil Fischer föreslog 1894 att detta kunde bero på att både enzymet och substratet besitter specifika och komplementära geometriska former som mycket precist passar ihop.[30] Detta benämns som "lås och nyckel"-modellen (en: "the lock and key model").
År 1958 föreslog Daniel Koshland en modifiering av denna modell. Eftersom enzymer har flexibel struktur kommer det aktiva centret att förändras till följd av interaktioner mellan substrat och enzym.[31] Detta resulterar i att substratet inte binder till ett oföränderligt aktivt centrum, utan aminosyrornas sidokedjor gjuts in i de exakta positioner som gör att enzymet kan utföra sin katalytiska funktion.[32] Det aktiva centrumet fortsätter att förändras till dess att substratet är fullständigt bundet.[33] Koshlands modell kallas ofta "inducerad passform" och är den modell som idag är allmänt accepterad.[34]
Alloster reglering
redigeraAllostera centrum är ställen på enzymer som binder molekyler i sin omgivning i cellen med svaga, icke-kovalenta bindningar och orsakar på så vis en konformationsändring av enzymet. Ändringen i konformation påverkar det aktiva centrumet och därigenom även enzymets reaktionshastighet.[35] Allostera interaktioner kan både hämma och aktivera enzymer. Många av kroppens enzymer regleras allostert.[36]
Kofaktorer och koenzymer
redigeraKofaktorer
redigeraMånga enzymer behöver binda till molekyler som inte är protein för att kunna uppvisa aktivitet. Dessa kallas kofaktorer.[37] Kofaktorer kan antingen vara oorganiska (exempelvis metalljoner och kol-svavel-kluster) eller organiska (exempelvis flavin och hem). Organiska kofaktorer kan antingen vara prostetiska grupper, vilka binder hårt till enzymet, eller koenzymer, vilka frisläpps från enzymets aktiva säte under den kemiska reaktionens gång. Exempel på koenzymer är NADH, NADPH och adenosintrifosfat. Dessa molekyler överför kemiska grupper mellan enzymer.[38]
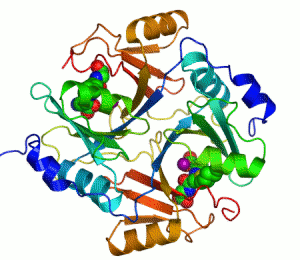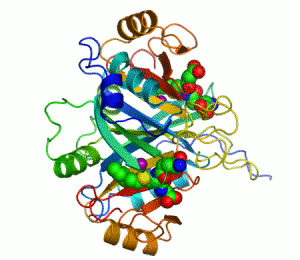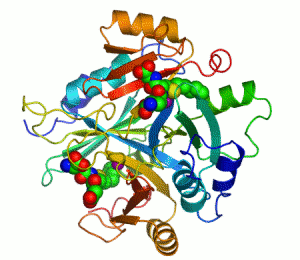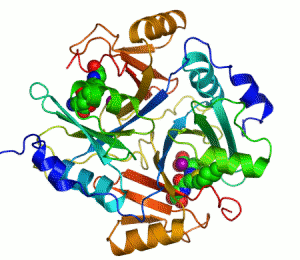
Ett exempel på enzym som innehåller en kofaktor är karboanhydras, som illustreras ovan med en zink-kofaktor inbunden som en del av dess aktiva centrum.[39] Dessa hårt bundna molekyler återfinns just oftast i det aktiva centrumet och deltar i katalysen.[21]
Enzymer som behöver en kofaktor kallas när den inte har bundit någon sådan för apoenzymer eller apoproteiner. Ett apoenzym tillsammans med dess kofaktor(er) kallas holoenzym (den aktiva formen). De flesta kofaktorer är inte kovalent bundna till ett enzym utan ligger bara väldigt tätt intill. Det finns dock organiska prostetiska grupper som kan binda kovalent (exempelvis tiaminpyrofosfat i enzymet pyruvatdehydrogenas). Termen holoenzym kan också appliceras på enzymer som innehåller flera subenheter, såsom DNA-polymeras; här är holoenzymet det fullständiga komplexet innehållande alla subenheter som behövs för aktivitet.[21][40]
Koenzymer
redigeraKoenzymer är små organiska molekyler som kan transportera kemiska grupper från ett enzym till ett annat.[41] Många koenzymer tillverkas utifrån vitaminer, exempelvis FADH från riboflavin och tetrahydrofolat från folsyra.[42]
Koenzymer återskapas vanligen kontinuerligt. På så sätt hålls deras koncentration på en jämn nivå i cellen. Detta kontinuerliga återskapande betyder att även små mängder koenzymer används mycket intensivt. Exempelvis förbrukar och återskapar kroppen ungefär sin egen vikt i ATP varje dag.[43]
Termodynamik
redigeraEnzymer kan koppla samman två eller fler reaktioner så att en termodynamiskt fördelaktig reaktion kan användas för att "driva" en termodynamiskt ofördelaktig. Till exempel används ofta hydrolys av ATP till att driva andra kemiska reaktioner.[44]
Enzymer påverkar inte jämvikten i sig, utan bara med vilken hastighet den uppnås. Vanligtvis går en reaktion i samma riktning i närvaro av ett enzym som i dess frånvaro men snabbare. Dock kan substrat ibland bilda flera olika produkter, och närvaro av enzym styr då vilken produkt som bildas. Enzymer, exempelvis karboanhydras, katalyserar reaktioner lika mycket i båda reaktionsriktningar. Vilken som kommer att dominera beror på koncentrationerna av substrat och produkt.
Om en jämvikt förskjuts mycket i en riktning, alltså i en kraftigt exergon reaktion, är reaktionen i princip irreversibel. Under dessa förhållanden kommer enzymer främst katalysera reaktionen i den termodynamiskt fördelaktiga riktningen.
Biologisk funktion
redigeraEnzymer har en mängd olika funktioner inuti levande organismer. De är oumbärliga för signaltransduktion och reglering av olika processer i cellen, ofta via kinaser och fosfataser vilka sätter på och tar av fosfatgrupper.[45]
Vissa enzym kan generera rörelse. Musklernas myosin hydrolyserar ATP för att generera muskelkontraktion, och enzymer i cellskelettet transporterar molekyler i cellen.[46]
ATPaser är en klass enzymer som katalyserar klyvning av ATP. ATPaser i cellmembranet fungerar som jonpumpar involverade i aktiv transport, då joner pumpas mot koncentrationsgradienten.
Mer ovanliga funktioner med enzymer inblandade är hur enzymet luciferas genererar ljus i lysmaskar.[47]
Virus kan innehålla enzymer för att kunna utföra vissa uppgifter, såsom HIV-integras och omvänt transkriptas för att kunna infektera värdceller. Influensa-viruset innehåller neuraminidas för att viruset ska kunna sättas fritt från cellerna.
Enzymer är mycket viktiga i djurs matspjälkningssystem. Enzymer så som amylaser och proteaser bryter ner större molekyler (stärkelse och protein respektive) så att de kan absorberas i tarmarna. Stärkelsemolekylerna hydrolyseras exempelvis till de mindre molekylerna maltos och till slut glukos, som kan absorberas. Olika enzymer bryter ner olika molekyler. Hos idisslare som enbart lever på växtdelar producerar mikroorganismer i tarmen enzymet cellulas för att möjliggöra nedbrytning av cellulosan i växternas cellväggar.[48]
Flera enzymer kan arbeta tillsammans i en specifik ordning, vilket skapar metabola reaktionsvägar. I en sådan reagerar ett enzym med produkten av ett annat enzym. Efter att enzymet utfört den katalytiska reaktionen går produkten sedan åter vidare till ett annat enzym. Ibland kan fler än ett enzym katalysera samma reaktion parallellt, något som kan ge upphov en komplex reglering där till exempel det ena enzymet kan tillhandahålla en konstant låg aktivitet och ett annat inducerbart enzym en mycket högre aktivitet.
Utan enzymer skulle metabolismen varken fungera på samma sätt eller vara tillräckligt snabb för att tillgodose cellens behov. Den centrala processen glykolysen skulle exempelvis aldrig kunna existera utan enzymer. Som ett exempel kan glukos i glykolysens första steg reagera direkt med ATP därigenom blir dess kol fosforylerade. Saknas enzymer sker dock denna reaktion så långsamt att den blir obetydlig. Om man istället tillsätter hexokinas till reaktionen sker samma långsamma fosforyleringar av kolen ske, med undantag för fosforyleringen av kol 6 som tack vare katalys sker mycket snabbt. Om lösningen undersöks efter en liten stund finner man att glukos-6-fosfat är den enda reaktionsprodukten som hittas i nämnvärd mängd.
Namngivning och klassificering
redigeraEnzymers namn brukar sluta på -as. Oftast har de fått namn från det substrat eller den kemiska reaktion det katalyserar, exempelvis laktas som bryter ner mjölksockret laktos, alkoholdehydrogenas som bryter ner alkohol i levern och DNA-polymeras.
Eftersom enzymen har namn efter vad de gör och det kan finnas flera olika enzymer som katalyserar samma reaktion, finns det ibland flera enzymer med samma namn. Dessa kallas isoenzymer. De har inte samma aminosyrasekvens och kan särskiljas genom till exempel det pH-värde den har störst aktivitet vid, kinetiska egenskaper eller genom immunokemiska metoder. Det förekommer att ett och samma enzym kan utföra katalys av en reaktion under fysiologiska förhållande och en annan under artificiella. Enzymet får då två namn, uppkallat efter vardera funktionen. Exempel på detta är glukosisomeras, som används industriellt för att omvandla glukos till sötningsmedlet fruktos. Under fysiologiska förhållanden är samma enzym ett xylosisomeras.
International Union of Biochemistry and Molecular Biology (IUBMB) har utvecklat en nomenklatur för enzymer, EC-nummer, där varje enzym beskrivs med en sekvens på fyra siffror föregångna av "EC". Det första numret är en grovklassificering beroende på vad enzymet gör.
Första klassificeringen är som följande:
- EC 1 Oxidoreduktaser: katalyserar oxidations- och reduktionsreaktioner
- EC 2 Transferaser: överför funktionella grupper (exempelvis metyl- eller fosfatgrupper)
- EC 3 Hydrolaser: katalyserar hydrolys av olika kemiska bindningar
- EC 4 Lyaser: klyver olika kemiska bindningar på andra sätt än hydrolys och oxidation
- EC 5 Isomeraser: katalyserar isomeriska ändringar inom en molekyl
- EC 6 Ligaser: katalyserar bildning av kovalenta bindningar mellan två molekyler
Utöver detta klassificeras enzymen in i underklasser.
Vissa webbservrar, såsom EzyPred[49] och andra verktyg inom bioinformatik har utvecklats för att förutsäga vilken huvudklass[50] och underklass[51][52] ett enzym tillhör bara genom att analysera dess proteinsekvens.
Industriell tillämpning
redigeraEnzymer används i den kemiska industrin och i andra industriella tillämpningar. Den industriella användningen av enzymer begränsas dock av enzymets naturliga specificitet för substrat, alltså vilka reaktioner de kan katalysera, och eftersom inte alltid fungerar vid andra betingelser än fysiologiska (exempelvis i organiska lösningsmedel eller vid höga temperaturer). Inom fältet proteinteknik görs försök att skapa nya enzymer med önskade egenskaper.[53][54] Dessa ansträngningar har börjat bära frukt. Några enzymer har designats från grunden för att katalysera reaktioner som inte sker i naturen.[55]
| Applikation | Enzymer som används | Användning |
| Livsmedelsindustrin |
Amylaser från svampar och växter. | Produktion av sockerarter från stärkelse, exempelvis tillverkning av glukossirap.[56]
I bakning, katalyserar nedbrytningen av stärkelse i mjöl till socker. Jäsning av socker med jäst bildar koldioxid som reser degen. |
| Proteaser | Kextillverkare använder dem för att minska proteinhalten i mjölet. | |
| Barnmat |
Trypsin | För att för-spjälka vissa proteiner i barnmat. |
| Ölbryggning |
Enzymer från korn frisätts under mäskfasen vid ölproduktion. | Bryter ner stärkelse och proteiner och bildar enkla sockerarter, aminosyror och peptider som används av jäst för jäsning. |
| Industriellt producerade korn-enzymer | Vanliga i bryggprocesser som ersättning för de naturliga enzymerna i korn. | |
| Amylaser, glukanaser, proteaser | Delar polysackarider och proteiner i malten. | |
| γ-Amylase and pullulanaser | Låg-kalori-öl och justering av jäsförmåga. | |
| Proteaser | Motverka grumlighet vid lagring av öl. | |
| Acetolaktatdekarboxylas | Förbättrar jäsningens effektivitet genom att minska bildandet av diacetyl.[57] | |
| Juicer |
Cellulaser, pektinaser | Gör juicer klarare. |
| Mejeriprodukter |
Rennin, utvunnet från unga djur såsom kalv och lamm. | Tillverkning av ost, används för att hydrolysera proteiner. |
| Lipaser | Används vid produktionen av exempelvis Roquefortost för att få blåmögelosten att mogna bättre. | |
| Laktaser | Bryter ner laktos till glukos och galaktos. | |
| Mörning |
Papain | För att möra kött genom att bryta ner proteiner. |
| Stärkelseindustrin |
Amylaser, amyloglukosidaser och glukoamylaser | Omvandlar stärkelse till glukos och olika invertsocker. |
| Xylosisomeras | Omvandlar glukos till fruktos vid produktion av isoglukoser från stärkelsematerial. Dessa isoglukoser är bättre sötningsmedel och lägre kaloriantal än sukroser med samma sötma. | |
| Massa- och pappersindustri |
Amylaser, xylanaser, cellulaser och ligninaser | Bryter ner stärkelse för att minska dess viskositet och hjälper på så vis sizing och täckande av pappret. |
| Biobränslen |
Cellulaser | Används för att bryta ner cellulosa till olika sockerarter som sedan kan fermenteras. |
| Ligninaser | För att kunna använda restprodukter av lignin. | |
| Biologiska lösningsmedel |
Främst proteaser producerade extracellulärt av bakterier. | Används i lösningar för borttagande av proteinfläckar på kläder. |
| Amylaser | Används i bland annat diskmedel för att ta bort fläckar baserade på stärkelse. | |
| Lipaser | Används för att underlätta borttagande av fett- och oljefläckar. | |
| Cellulaser | Används i sköljmedel. | |
| Linsvätska |
Proteaser | Borttagande av proteiner från kontaktlinser för att förhindra infektioner. |
| Gummiindustrin | Katalas | För att generera syre från peroxid för att omvandla latex till gummi. |
| Fotografi |
Proteaser | Löser upp gelatin från film för att kunna återanvända dess innehåll av silver. |
| Molekylärbiologi |
Restriktionsenzymer, DNA-ligas och polymeraser med flera. | Används för att manipulera DNA inom genteknik, något som är viktigt inom bland annat farmakologi, jordbruk, kriminalteknik och medicin. Enzymerna är essentiella för tekniker såsom restriktionsklyvning och PCR. |
Se även
redigeraReferenser
redigera- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Enzyme, tidigare version.
Källnoter
redigera- ^ Smith AL (Ed) et al. (1997) (på engelska). Oxford dictionary of biochemistry and molecular biology. Oxford [Oxfordshire]: Oxford University Press. ISBN 0-19-854768-4
- ^ Grisham, Charles M.; Reginald H. Garrett (1999) (på engelska). Biochemistry. Philadelphia: Saunders College Pub. sid. 426–7. ISBN 0-03-022318-0
- ^ Bairoch A. (2000). ”The ENZYME database in 2000” (på engelska) (PDF). Nucleic Acids Res 28 (1): sid. 304–5. doi:. ISSN 0305-1048. PMID 10592255. PMC: 102465. Arkiverad från originalet den 1 juni 2011. https://web.archive.org/web/20110601003507/http://www.expasy.org/NAR/enz00.pdf. Läst 12 november 2010. Arkiverad 1 juni 2011 hämtat från the Wayback Machine.
- ^ Lilley D (2005). ”Structure, folding and mechanisms of ribozymes” (på engelska). Curr Opin Struct Biol 15 (3): sid. 313–23. doi:. PMID 15919196.
- ^ Cech T (2000). ”Structural biology. The ribosome is a ribozyme” (på engelska). Science 289 (5481): sid. 878–9. doi:. PMID 10960319.
- ^ Groves JT (1997). ”Artificial enzymes. The importance of being selective” (på engelska). Nature 389 (6649): sid. 329–30. doi:. PMID 9311771.
- ^ de Réaumur, RAF (1752). ”Observations sur la digestion des oiseaux”. Histoire de l'academie royale des sciences 1752: sid. 266, 461.
- ^ Williams, H. S. (1904). A History of Science: in Five Volumes. Volume IV: Modern Development of the Chemical and Biological Sciences. New York: Harper and Brothers. http://etext.lib.virginia.edu/toc/modeng/public/Wil4Sci.html
- ^ Dubos J. (1951). ”Louis Pasteur: Free Lance of Science, Gollancz. Quoted in Manchester K. L. (1995) Louis Pasteur (1822–1895)—chance and the prepared mind”. Trends Biotechnol 13 (12): sid. 511–5. doi:. PMID 8595136.
- ^ Kühne myntade termen "enzyme" i: W. Kühne (1877) "Über das Verhalten verschiedener organisirter und sog. ungeformter Fermente", Verhandlungen des naturhistorisch-medicinischen Vereins zu Heidelberg, vol. 1, nummer 3, sidorna 190-193. relevanta stycket finns att finna på sidan 190: "Um Missverständnissen vorzubeugen und lästige Umschreibungen zu vermeiden schlägt Vortragender vor, die ungeformten oder nicht organisirten Fermente, deren Wirkung ohne Anwesenheit von Organismen und ausserhalb derselben erfolgen kann, als Enzyme zu bezeichnen." (Översättning: För att förebygga missförstånd och undvika besvärliga omskrivningar, föreslår författaren att man betecknar de oformade eller inte organiserade ferment, vilkas verkning kan ske utan närvaron av organismen och utanför den samma, som Enzyme.)
- ^ ”Eduard Buchner – Biography” (på engelska). Nobelprize.org. https://www.nobelprize.org/prizes/chemistry/1907/buchner/biographical/. Läst 30 oktober 2018.
- ^ ”Eduard Buchner's 1907 Nobel lecture – Cell-Free Fermentation” (på engelska). Nobelprize.org. https://www.nobelprize.org/prizes/chemistry/1907/buchner/lecture/. Läst 30 oktober 2018.
- ^ ”Pristagare Kungl. Vetenskapsakademin: Eduard Buchner”. Kungl. Vetenskapsakademin. Arkiverad från originalet den 3 december 2022. https://web.archive.org/web/20221203002016/https://www.kva.se/prisvinnare/eduard-buchner/. Läst 30 oktober 2018. ”för hans biologiskkemiska undersökningar och upptäckt av den cellfria jäsningen”
- ^ ”The Nobel Prize in Chemistry 1946” (på engelska). Nobelprize.org. https://www.nobelprize.org/prizes/chemistry/1946/. Läst 30 oktober 2018.
- ^ Blake CC, Koenig DF, Mair GA, North AC, Phillips DC, Sarma VR. (1965). ”Structure of hen egg-white lysozyme. A three-dimensional Fourier synthesis at 2 Angstrom resolution”. Nature 22 (206): sid. 757–61. doi:. PMID 5891407.
- ^ Chen LH, Kenyon GL, Curtin F, Harayama S, Bembenek ME, Hajipour G, Whitman CP (1992). ”4-Oxalocrotonate tautomerase, an enzyme composed of 62 amino acid residues per monomer”. J. Biol. Chem. 267 (25): sid. 17716–21. PMID 1339435.
- ^ Smith S (1 december 1994). ”The animal fatty acid synthase: one gene, one polypeptide, seven enzymes”. FASEB J. 8 (15): sid. 1248–59. PMID 8001737. http://www.fasebj.org/content/8/15/1248.full.pdf+html. Läst 14 november 2010.
- ^ Anfinsen C.B. (1973). ”Principles that Govern the Folding of Protein Chains”. Science 181 (96): sid. 223–30. doi:. PMID 4124164.
- ^ Dunaway-Mariano D (2008). ”Enzyme function discovery”. Structure 16 (11): sid. 1599–600. doi:. PMID 19000810.
- ^ ”The Catalytic Site Atlas”. The European Bioinformatics Institute. Arkiverad från originalet den 3 augusti 2013. https://web.archive.org/web/20130803032349/http://www.ebi.ac.uk/thornton-srv/databases/CSA/. Läst 14 november 2010..
- ^ [a b c] Alberts, Bruce et al. (2005). Essential Cell Biology (2:a upplagan). Garland Science. sid. 207, 214. ISBN 0-8153-3481-8
- ^ Alberts, Bruce et al. (2005). Essential Cell Biology (2:a upplagan). Garland Science. sid. 49-52. ISBN 0-8153-3481-8
- ^ Alberts, Bruce et al. (2005). Essential Cell Biology (2:a upplagan). Garland Science. sid. 288-289. ISBN 0-8153-3481-8
- ^ Jaeger KE, Eggert T. (2004). ”Enantioselective biocatalysis optimized by directed evolution”. Curr Opin Biotechnol. 15 (4): sid. 305–13. doi:. PMID 15358000.
- ^ Shevelev IV, Hubscher U. (2002). ”The 3' 5' exonucleases”. Nat Rev Mol Cell Biol. 3 (5): sid. 364–76. doi:. PMID 11988770.
- ^ Berg, Jeremy M. et al. (2006). Biochemistry (6:e upplagan). New York: W.H. Freeman and Company. ISBN 978-0-7167-6766-4
- ^ Zenkin N, Yuzenkova Y, Severinov K. (2006). Transcript-assisted transcriptional proofreading. "313". sid. 518–20. doi:. PMID 16873663.
- ^ Ibba M, Soll D. (2000). ”Aminoacyl-tRNA synthesis”. Annu Rev Biochem. 69: sid. 617–50. doi:. PMID 10966471.
- ^ Rodnina MV, Wintermeyer W. (2001). ”Fidelity of aminoacyl-tRNA selection on the ribosome: kinetic and structural mechanisms”. Annu Rev Biochem. 70: sid. 415–35. doi:. PMID 11395413.
- ^ Fischer E. (1894). ”Einfluss der Configuration auf die Wirkung der Enzyme”. Ber. Dt. Chem. Ges. 27: sid. 2985–93. doi:. http://gallica.bnf.fr/ark:/12148/bpt6k90736r/f364.chemindefer.
- ^ Koshland D. E. (1958). ”Application of a Theory of Enzyme Specificity to Protein Synthesis”. Proc. Natl. Acad. Sci. 44 (2): sid. 98–104. doi:. PMID 16590179.
- ^ Vasella A, Davies GJ, Bohm M. (2002). ”Glycosidase mechanisms”. Curr Opin Chem Biol. 6 (5): sid. 619–29. doi:. PMID 12413546.
- ^ Boyer, Rodney (2002). ”6” (på engelska). Concepts in Biochemistry (2:a upplagan). New York, Chichester, Weinheim, Brisbane, Singapore, Toronto.: John Wiley & Sons, Inc. sid. 137–8. ISBN 0-470-00379-0. OCLC 51720783
- ^ Alberts, Bruce et al. (2005). Essential Cell Biology (2:a upplagan). Garland Science. sid. 215. ISBN 0-8153-3481-8
- ^ Neet KE (1995). ”Cooperativity in enzyme function: equilibrium and kinetic aspects”. Meth. Enzymol. 249: sid. 519–67. doi:. PMID 7791626.
- ^ Changeux JP, Edelstein SJ (2005). ”Allosteric mechanisms of signal transduction”. Science 308 (5727): sid. 1424–8. doi:. PMID 15933191.
- ^ de Bolster, M.W.G. (1997). ”Glossary of Terms Used in Bioinorganic Chemistry: Cofactor” (på engelska). International Union of Pure and Applied Chemistry. Arkiverad från originalet den 21 januari 2017. https://web.archive.org/web/20170121172848/http://www.chem.qmul.ac.uk/iupac/bioinorg/CD.html#34#34. Läst 12 november 2010.
- ^ de Bolster, M.W.G. (1997). ”Glossary of Terms Used in Bioinorganic Chemistry: Coenzyme”. International Union of Pure and Applied Chemistry. Arkiverad från originalet den 21 januari 2017. https://web.archive.org/web/20170121172848/http://www.chem.qmul.ac.uk/iupac/bioinorg/CD.html#33#33. Läst 12 november 2010.
- ^ Fisher Z, Hernandez Prada JA, Tu C, Duda D, Yoshioka C, An H, Govindasamy L, Silverman DN and McKenna R. (2005). ”Structural and kinetic characterization of active-site histidine as a proton shuttle in catalysis by human carbonic anhydrase II”. Biochemistry 44 (4): sid. 1097–115. doi:. PMID 15667203.
- ^ ”PDBs for Biochemistry”. Georgia State University. Arkiverad från originalet den 16 juli 2011. https://web.archive.org/web/20110716103545/http://chemistry.gsu.edu/Glactone/PDB/Proteins/Krebs/1pyd.html. Läst 22 januari 2011.
- ^ Wagner, Arthur L. (1975) (på engelska). Vitamins and Coenzymes. Krieger Pub Co. ISBN 0-88275-258-8
- ^ Alberts et al. (2008). Molecular Biology of the Cell (5:e upplagan). Garland Science. sid. 166-177 samt tabell 3-2. ISBN 0-8153-4106-7
- ^ Törnroth-Horsefield S, Neutze R (2008). ”Opening and closing the metabolite gate”. Proc. Natl. Acad. Sci. U.S.A. 105 (50): sid. 19565–6. doi:. PMID 19073922. PMC: 2604989. http://www.pnas.org/cgi/pmidlookup?view=long&pmid=19073922.
- ^ Ferguson, S. J.; Nicholls, David; Ferguson, Stuart (2002) (på engelska). Bioenergetics 3 (3:e upplagan). San Diego: Academic. ISBN 0-12-518121-3
- ^ Hunter T. (1995). ”Protein kinases and phosphatases: the yin and yang of protein phosphorylation and signaling”. Cell. 80 (2): sid. 225–36. doi:. PMID 7834742.
- ^ Berg JS, Powell BC, Cheney RE (1 April 2001). ”A millennial myosin census”. Mol. Biol. Cell 12 (4): sid. 780–94. PMID 11294886. PMC: 32266. http://www.molbiolcell.org/cgi/content/full/12/4/780.
- ^ Meighen EA (1 Mars 1991). ”Molecular biology of bacterial bioluminescence”. Microbiol. Rev. 55 (1): sid. 123–42. PMID 2030669. PMC: 372803. http://mmbr.asm.org/cgi/reprint/55/1/123?view=long&pmid=2030669.
- ^ Mackie RI, White BA (1 oktober 1990). ”Recent advances in rumen microbial ecology and metabolism: potential impact on nutrient output”. J. Dairy Sci. "73" (10): ss. 2971–95. doi:. PMID 2178174. http://jds.fass.org/cgi/reprint/73/10/2971.
- ^ Shen H. B., Chou K. C. (2007). ”EzyPred: A top-down approach for predicting enzyme functional classes and subclasses.” (på engelska). Biochem Biophys Res Comm 364: sid. 53-59..
- ^ Qiu J. D., Huang J. H., Shi S. P., Liang R. P. (2010). ”Using the Concept of Chou's Pseudo Amino Acid Composition to Predict Enzyme Family Classes: An Approach with Support Vector Machine Based on Discrete Wavelet Transform.”. Protein & Peptide Letters (17): sid. 715-712.
- ^ Zhou, X. B., Chen, C., Li, Z. C. & Zou, X. Y. (2007). ”Using Chou's amphiphilic pseudo-amino acid composition and support vector machine for prediction of enzyme subfamily classes”. Journal of Theoretical Biology 248 (3): sid. 546–551. doi:. PMID 17628605.
- ^ Chou K. C. (2005). ”Using amphiphilic pseudo amino acid composition to predict enzyme subfamily classes.”. Bioinformatics 21: sid. 10-19.
- ^ Renugopalakrishnan V, Garduno-Juarez R, Narasimhan G, Verma CS, Wei X, Li P. (2005). ”Rational design of thermally stable proteins: relevance to bionanotechnology”. J Nanosci Nanotechnol. 5 (11): sid. 1759–1767. doi:. PMID 16433409.
- ^ Hult K, Berglund P. (2003). ”Engineered enzymes for improved organic synthesis”. Curr Opin Biotechnol. 14 (4): sid. 395–400. doi:. PMID 12943848.
- ^ Jiang L, Althoff EA, Clemente FR (2008). ”De novo computational design of retro-aldol enzymes”. Science (journal) 319 (5868): sid. 1387–91. doi:. PMID 18323453.
- ^ Guzmán-Maldonado H, Paredes-López O (1995). ”Amylolytic enzymes and products derived from starch: a review”. Critical reviews in food science and nutrition 35 (5): sid. 373–403. doi:. PMID 8573280.
- ^ Dulieu C, Moll M, Boudrant J, Poncelet D (2000). ”Improved performances and control of beer fermentation using encapsulated alpha-acetolactate decarboxylase and modeling”. Biotechnology progress 16 (6): sid. 958–65. doi:. PMID 11101321.
Engelska originalcitat
redigera- ^ "alcoholic fermentation is an act correlated with the life and organization of the yeast cells, not with the death or putrefaction of the cells."
Externa länkar
redigera- Wikimedia Commons har media som rör Enzym.
- Enzyme Structures Database, en databas som ger tillgång till samtliga 3D-strukturer i Protein Data Bank (PDB).
- MetaCyc, en databas med över 1670 metabola reaktionsvägar från fler än 2100 organismer.
- Brenda, en databas med bred information kring enzymer.
- ExPASy ENZYME, en sökverktyg främst i Swiss-prot, men länkar även andra databaser och annan litteratur.
- IUBMB, International Union of Biochemistry and Molecular Biology tillhandahåller en rekommenderad nomenklatur och klassificering av enzymer.