Isopropanol
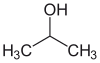
Isopropanol, isopropylalkohol (IPA)[1] eller 2-propanol är den enklaste sekundära alkoholen. Den har formeln CH(CH3)2OH.
| Isopropanol | |
  | |
| Systematiskt namn | Propan-2-ol |
|---|---|
| Övriga namn | Isopropylalkohol |
| Kemisk formel | C3H7OH eller CH(CH3)2OH |
| Molmassa | 60,10 g/mol |
| Utseende | Färglös vätska |
| CAS-nummer | 67-63-0 |
| SMILES | CC(O)C |
| Egenskaper | |
| Densitet | 0,786 g/cm³ |
| Löslighet (vatten) | Blandbar |
| Smältpunkt | -89 °C |
| Kokpunkt | 82,3 °C |
| Faror | |
| Huvudfara | |
| NFPA 704 | |
| LD50 | 5045 mg/kg |
| SI-enheter & STP används om ej annat angivits | |

Egenskaper
redigeraIsopropanol är en lättflyktig, färglös vätska med sötaktig lukt. Isopropanol och vatten bildar en azeotrop lösning vid 87,9%. Ren isopropanol kan fås genom att den löses i cyklohexan eller diisopropyleter och sedan destilleras.
Till skillnad från etanol och metanol kan isopropanol fällas ut från en lösning genom att man tillsätter ett vattenlösligt salt. Saltet tränger ut alkoholen från lösningen och koncentrerad isopropanol flyter upp och lägger sig ovanpå vattnet.
Framställning
redigeraIsopropanol kan tillverkas genom hydratisering av propen (C3H6) med vatten (H2O).
Processen kan göras effektivare genom att först lösa propen i svavelsyra (H2SO4), vilket ger estrar som sedan lätt kan hydrolyseras. Markovnikovs regel gör att endast en liten mängd vanlig propanol bildas.
Isopropanol kan också framställas av aceton ((CH3)2CO) och vätgas (H2).
Användning
redigeraIsopropanol används som lösnings- och extraktionsmedel samt som antifrysmedel bland annat i motorbränslen, vid tillverkning av läkemedel, aceton och andra kemikalier. Det används även för att rengöra elektronik av olika slag.
Risker
redigeraInandning av stora mängder kan ge huvudvärk, yrsel, kräkningar och i svårare fall medvetslöshet. Vätskan avfettar huden; upprepad hudkontakt kan ge eksem. Stänk i ögonen verkar irriterande. Förtäring av isopropanol är mycket hälsofarligt och kräver omedelbar sjukhusvård.
Isopropanol är mycket brandfarlig; med luftens syre och med ljus kan explosiva peroxider bildas.
Källor
redigera- Material Safety Data Sheet Mallinckrodt Baker (Ogiltig källa, uppdatera?)
Noter
redigera- ^ ”IPA eller isopropylalkohol är en mycket användbar alkoholkomponent”. Esstronic.com. Arkiverad från originalet den 2 april 2016. https://web.archive.org/web/20160402044642/http://www.esstronic.com/fuel/swe/ipa-s.htm. Läst 19 september 2017.
