1,4-alfaglukandelningsenzym
1,4-alfaglukandelningsenzym, även känt som förgreningsenzym, är ett enzym involverat i syntesen av glykogen i kroppens celler. Mer specifikt, under glykogensyntes, reagerar en glukos 1-fosfatmolekyl med uridintrifosfat (UTP) för att bli UDP-glukos, en aktiverad form av glukos. Den aktiverade glukosylenheten av UDP-glukos överförs sedan till hydroxylgruppen vid C-4 i en terminal rest av glykogen för att bilda en α-1,4- glykosidbindning, en reaktion som katalyseras av glykogensyntas. Viktigt är att glykogensyntas endast kan katalysera syntesen av a-1,4-glykosidbindningar. Eftersom glykogen är en lättmobiliserad lagringsform av glukos, förgrenas den förlängda glykogenpolymeren av glykogenförgrenande enzym för att tillhandahålla glykogennedbrytningsenzymer, som glykogenfosforylas, med många terminala rester för snabb nedbrytning. Förgrening ökar också väsentligt lösligheten och minskar den osmotiska styrkan hos glykogen.[1]
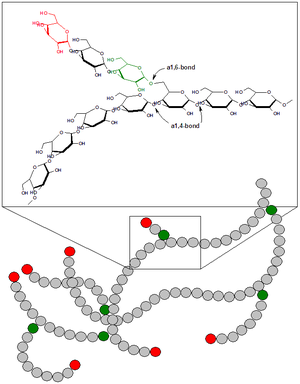
Proteinet som kodas av denna gen är ett glykogenförgrenande enzym som katalyserar överföringen av alfa-1,4-kopplade glukosylenheter från den yttre änden av en glykogenkedja till en alfa-1,6-position på samma eller en angränsande glykogenkedja. Förgrening av kedjorna är avgörande för att öka lösligheten av glykogenmolekylen och följaktligen för att minska det osmotiska trycket i cellerna. De högsta nivåerna av detta enzym finns i lever- och muskelceller. Mutationer i denna gen förknippas med glykogenlagringssjukdom typ IV (även känd som Andersens sjukdom).
Gen
redigeraGBE kodas av GBE1-genen.[2][3][4][5]
Genom Southern blot-analys av DNA som härrör från humana/gnagare somatiska cellhybrider har GBE1 identifierats som en autosomal gen belägen på den korta armen av kromosom 3 i position 12.3.[3][4][5][6] Den mänskliga GBE-genen isolerades också genom ett funktionskomplement av Saccharomyces cerevisiae GBE-brist.[6] Från det isolerade cDNA:t visade sig längden på genen vara cirka 3 kb.[6] Dessutom visade sig den kodande sekvensen omfatta 2 106 baspar och koda för en 702 aminosyror lång GBE. Molekylmassan för humant GBE beräknades till 80 438 Da.[6]
Struktur
redigeraGlykogenförgreningsenzym tillhör α-amylasfamiljen av enzymer, som inkluderar α-amylaser, pullulanas/isoamylas, cyklodextringlukanotransferas (CGT) och grenenzym.[7][8] Visat med röntgenkristallografi, har glykogenförgreningsenzym fyra marginellt asymmetriska enheter vardera som är organiserade i tre domäner: en aminoterminal domän, med uppgift att bestämma längden på kedjeöverföringen, en karboxylterminal domän för substratpreferens och katalytisk kapacitet, och en central (a/p) katalytisk domän.[7][9][10][11] Den aminoterminala domänen består av 128 rester ordnade i sju β-strängar, den karboxylterminala domänen med 116 rester också organiserade i sju β-strängar, och (α/β) ) fatdomän med 372 rester. Medan den centrala (α/β) cylinderdomänen är vanlig hos medlemmar av a-amylasfamiljen, finns det många variationer mellan de olika fatdomänerna. Dessutom finns det slående skillnader mellan slingorna som förbinder elementen i den sekundära strukturen bland dessa olika a-amylasmedlemmar, speciellt runt det aktiva stället. I jämförelse med de andra familjemedlemmarna har glykogenbindande enzym kortare slingor, vilket resulterar i en mer öppen hålighet, gynnsam för bindningen av ett skrymmande substrat såsom grenat socker. Genom primär strukturanalys och röntgenkristallografiska strukturer av medlemmarna av a-amylasfamiljen, konserverades sju rester, Asp335, His340, Arg403, Asp 405, Glu458, His525 och Asp526 (E coli.-numrering). Dessa rester är inblandade i katalys och substratbindning.[7]
Glykogenbindande enzymer i andra organismer har också kristalliserats och strukturellt bestämts, vilket visar både likhet och variation med GBE som finns i Escherichia coli.[12][13][14][15]
Funktion
redigeraI glykogen , var 10:e till 14:e glukosenhet, uppstår en sidogren med ytterligare en kedja av glukosenheter. Sidokedjan fäster vid kolatom 6 i en glukosenhet, en α-1,6-glykosidbindning. Denna koppling katalyseras av ett förgrenande enzym, vanligtvis benämnt α-glukan förgreningsenzym. Ett förgrenande enzym fäster en sträng med sju glukosenheter (med viss mindre variation av detta antal) till kolet vid C-6-positionen på glukosenheten, och bildar α-1,6-glykosidbindningen. Den specifika naturen hos detta enzym innebär att denna kedja med 7 kol vanligtvis är fäst vid en glukosmolekyl som är i position tre från den icke-reducerande änden av en annan kedja. Eftersom enzymet arbetar med sådan specificitet vad gäller antalet glukosenheter som överförs och den position till vilken de överförs, skapar enzymet den mycket karakteristiska, mycket grenade glykogenmolekylen.[16]
Klinisk betydelse
redigeraMutationer i denna gen är förknippad med glykogenlagringssjukdom typ IV (även känd som Andersens sjukdom) hos nyfödda och med polyglukosan kroppssjukdom hos vuxna.[2][17]
Cirka 40 mutationer i GBE1-genen, de flesta som resulterar i en punktmutation i det glykogenförgrenande enzymet, har lett till sjukdomen i den tidiga barndomen, glykogenlagringssjukdom typ IV (GSD IV).[5] Denna sjukdom kännetecknas av en allvarlig utarmning eller fullständig frånvaro av GBE, vilket resulterar i ackumulering av onormalt strukturerat glykogen, känd som polyglukosankroppar. Glykogenuppbyggnad leder till ökat osmotiskt tryck vilket[5] resulterar i cellulär svullnad och död.[5] De vävnader som drabbas mest av denna sjukdom är levern, hjärtat och det neuromuskulära systemet, områden med de största nivåerna av glykogenackumulering.[5][18] Onormal glykogenuppbyggnad i levern stör leverns funktion och kan resultera i en förstorad lever och leversjukdom.[5][19] I muskler kan cellers oförmåga att effektivt bryta ner glykogen på grund av den kraftiga minskningen eller frånvaron av förgrening leda till muskelsvaghet och atrofi.[5] Minst tre mutationer i GBE1-genen har visat sig orsaka en annan sjukdom som kallas adult polyglucosan body disease (APBD).[5][20] Medan i GSD IV GBE-aktivitet är oupptäckbar eller minimalt detekterbar, kännetecknas APBD av minskad eller till och med normal GBE-aktivitet.[20] I denna sjukdom kan onormalt glykogen byggas upp i nervceller vilket leder till ett spektrum av problem. Specifikt är vissa sjukdomskännetecken gångsvårigheter från blandade övre och nedre motorneuroner, sensorisk förlust i nedre extremiteter och neurogen urinblåsa, ett problem där en person saknar kontroll över urinblåsan på grund av ett hjärn-, ryggmärgs- eller nervtillstånd.[20][21]
Referenser
redigera- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Glycogen-branching enzyme, 29 augusti 2024.
Noter
redigera- ^ Biochemistry (Seventh). W.H. Freeman and Company. 2012. Sid. 627–630.
- ^ [a b] ”Entrez Gene: glucan (1,4-alpha-), branching enzyme 1”. Entrez Gene: glucan (1,4-alpha-), branching enzyme 1. https://www.ncbi.nlm.nih.gov/sites/entrez?db=gene&cmd=retrieve&list_uids=2632.
- ^ [a b] ”GBE1 glucan (1,4-alpha-), branching enzyme 1 [ Homo sapiens (human) ”]. National Center for Biotechnology Information. US. National Library of Medicine. https://www.ncbi.nlm.nih.gov/gene?cmd=retrieve&list_uids=2632.
- ^ [a b] ”Glycogen Branching Enzyme; GBE1”. Online Mendelian Inheritance in Man. Johns Hopkins University. http://www.omim.org/entry/607839.
- ^ [a b c d e f g h i] Genetics Home Reference. ”GBE1”. GBE1. U.S. National Library of Medicine. http://ghr.nlm.nih.gov/gene/GBE1.
- ^ [a b c d] ”Isolation of human glycogen branching enzyme cDNAs by screening complementation in yeast”. The Journal of Biological Chemistry 268 (10): sid. 7509–7513. April 1993. doi:. PMID 8463281.
- ^ [a b c] ”The X-ray crystallographic structure of Escherichia coli branching enzyme”. The Journal of Biological Chemistry. 44 277 (44): sid. 42164–42170. November 2002. doi:. PMID 12196524.
- ^ ”Crystal structure of full-length Mycobacterium tuberculosis H37Rv glycogen branching enzyme: insights of N-terminal beta-sandwich in substrate specificity and enzymatic activity”. The Journal of Biological Chemistry 285 (27): sid. 20897–20903. July 2010. doi:. PMID 20444687.
- ^ ”Structure and possible catalytic residues of Taka-amylase A”. Journal of Biochemistry 95 (3): sid. 697–702. March 1984. doi:. PMID 6609921.
- ^ ”Three dimensional structure of porcine pancreatic alpha-amylase at 2.9 A resolution. Role of calcium in structure and activity”. The EMBO Journal 6 (13): sid. 3909–3916. December 1987. doi:. PMID 3502087.
- ^ ”Characterization of the branching patterns of glycogen branching enzyme truncated on the N-terminus”. Archives of Biochemistry and Biophysics 418 (1): sid. 34–38. October 2003. doi:. PMID 13679080.
- ^ ”Construction of chimeric enzymes out of maize endosperm branching enzymes I and II: activity and properties”. The Journal of Biological Chemistry 272 (46): sid. 28999–29004. November 1997. doi:. PMID 9360973.
- ^ ”Thermus thermophilus glycoside hydrolase family 57 branching enzyme: crystal structure, mechanism of action, and products formed”. The Journal of Biological Chemistry 286 (5): sid. 3520–3530. February 2011. doi:. PMID 21097495.
- ^ ”Structural basis for branching-enzyme activity of glycoside hydrolase family 57: structure and stability studies of a novel branching enzyme from the hyperthermophilic archaeon Thermococcus kodakaraensis KOD1”. Proteins 79 (2): sid. 547–557. February 2011. doi:. PMID 21104698.
- ^ ”Crystal structure of the branching enzyme I (BEI) from Oryza sativa L with implications for catalysis and substrate binding”. Glycobiology 21 (8): sid. 1108–1116. August 2011. doi:. PMID 21493662.
- ^ The Chemistry of Life. Pelican Books. 1999. Sid. 199–201.
- ^ ”OMIM Entry 263570 - Polyglucosan body neuropathy, adult form” (på amerikansk engelska). Online Mendelian Inheritance in Man. Johns Hopkins University. May 2, 2016. https://omim.org/entry/263570.
- ^ ”Glycogen Storages Diseases chapter of Molecular Pathology of Liver Diseases”. Molecular Pathology of Liver Diseases. Springer. 2011. Sid. 677–682. ISBN 9781441971074.
- ^ ”Clinical and genetic heterogeneity of branching enzyme deficiency (glycogenosis type IV)”. Neurology 63 (6): sid. 1053–1058. September 2004. doi:. PMID 15452297.
- ^ [a b c] ”Adult Polyglucosan Body Disease”. GeneReviews. University of Washington, Seattle. 1993.
- ^ ”The adult polyglucosan body disease mutation GBE1 c.1076A>C occurs at high frequency in persons of Ashkenazi Jewish background”. Biochemical and Biophysical Research Communications 426 (2): sid. 286–288. September 2012. doi:. PMID 22943850.
Vidare läsning
redigera- ”The enzymic synthesis and degradation of starch. Part IV. The purification and storage of the Q-enzyme of the potato”. Journal of the Chemical Society (Resumed): sid. 1705–1711. 1949. doi:.
- ”A simple method for the preparation of crystalline potato phosphorylase and Q-enzyme”. Nature 171 (4361): sid. 983–984. May 1953. doi:. PMID 13063502. Bibcode: 1953Natur.171..983B.
- ”Enzymic Synthesis of Polysaccharides: A Biological type of Polymerization”. Advances in Enzymology - and Related Areas of Molecular Biology. "11". 1951. 297–337. doi:. ISBN 978-0-470-12256-3.
- ”Follicle-stimulating hormone increases primordial follicle reserve in mature female hypogonadal mice”. The Journal of Endocrinology 188 (3): sid. 549–557. March 2006. doi:. PMID 16522734.
- ”A human protein-protein interaction network: a resource for annotating the proteome”. Cell 122 (6): sid. 957–968. September 2005. doi:. PMID 16169070.
- ”Adult polyglucosan body disease: proton magnetic resonance spectroscopy of the brain and novel mutation in the GBE1 gene”. Muscle & Nerve 37 (4): sid. 530–536. April 2008. doi:. PMID 17994551.
- ”Personalized smoking cessation: interactions between nicotine dose, dependence and quit-success genotype score”. Molecular Medicine 16 (7–8): sid. 247–253. 2010. doi:. PMID 20379614.
- ”The axon guidance receptor gene ROBO1 is a candidate gene for developmental dyslexia”. PLOS Genetics 1 (4): sid. e50. October 2005. doi:. PMID 16254601.
- ”Placental involvement in glycogen storage disease type IV”. Placenta 29 (4): sid. 378–381. April 2008. doi:. PMID 18289670.
- ”Analyses of shared genetic factors between asthma and obesity in children”. The Journal of Allergy and Clinical Immunology 126 (3): sid. 631–7.e1–8. September 2010. doi:. PMID 20816195.
- ”Clinical and genetic heterogeneity of branching enzyme deficiency (glycogenosis type IV)”. Neurology 63 (6): sid. 1053–1058. September 2004. doi:. PMID 15452297.
- ”Novel missense mutations in the glycogen-branching enzyme gene in adult polyglucosan body disease”. Annals of Neurology 47 (4): sid. 536–540. April 2000. doi:. PMID 10762170.
- ”Evidence for substantial effect modification by gender in a large-scale genetic association study of the metabolic syndrome among coronary heart disease patients”. Human Genetics 114 (1): sid. 87–98. December 2003. doi:. PMID 14557872.
- ”Fatal infantile neuromuscular presentation of glycogen storage disease type IV”. Neuromuscular Disorders 14 (4): sid. 253–260. April 2004. doi:. PMID 15019703.
- ”Hypoxia promotes glycogen accumulation through hypoxia inducible factor (HIF)-mediated induction of glycogen synthase 1”. PLOS ONE 5 (3): sid. e9644. March 2010. doi:. PMID 20300197. Bibcode: 2010PLoSO...5.9644P.
- ”Neuromuscular forms of glycogen branching enzyme deficiency”. Acta Myologica 26 (1): sid. 75–78. July 2007. PMID 17915577.
- ”Investigation of genetic susceptibility factors for human longevity - a targeted nonsynonymous SNP study”. Mutation Research 694 (1–2): sid. 13–19. December 2010. doi:. PMID 20800603. Bibcode: 2010MRFMM.694...13F.
- ”Immunoaffinity profiling of tyrosine phosphorylation in cancer cells”. Nature Biotechnology 23 (1): sid. 94–101. January 2005. doi:. PMID 15592455.
- ”Variation at the NFATC2 locus increases the risk of thiazolidinedione-induced edema in the Diabetes REduction Assessment with ramipril and rosiglitazone Medication (DREAM) study”. Diabetes Care 33 (10): sid. 2250–2253. October 2010. doi:. PMID 20628086.
Externa länkar
redigera- Wikimedia Commons har media som rör 1,4-alfaglukandelningsenzym.
- GeneReviews/NCBI/NIH/UW entry on Adult Polyglucosan Body Disease
- OMIM entries on Adult Polyglucosan Body Disease
- Overview of all the structural information available in the PDB for UniProt: Q04446 (1,4-alpha-glucan-branching enzyme) at the PDBe-KB.