Tetracyanoeten
Tetracyanoeten (TCNE) är en giftig, elektronfattig, starkt oxiderande förening som bildar ett vitt bittermandelluktande pulver med smältpunkt 199 °C. Med aromatiska föreningar ger den starkt färgade π-komplex, vilka kan utnyttjas för analytiska ändamål.
| Tetracyanoeten | |
  | |
| Systematiskt namn | etentetracarbonitril |
|---|---|
| Övriga namn | TCNE |
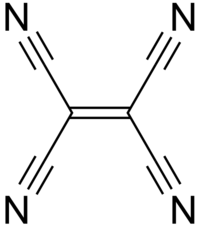
| Kemisk formel | C6N4 |
| Molmassa | 128,09 g/mol |
| Utseende | Vitt pulver |
| CAS-nummer | 670-54-2 |
| SMILES | (NC) 2C=C(CN) 2 |
| Egenskaper | |
| Densitet | 1,348 g/cm³ |
| Smältpunkt | 199 °C |
| Kokpunkt | 223 °C 130-140 (sublimerar) °C |
| Faror | |
| Huvudfara | |
| SI-enheter & STP används om ej annat angivits | |
TCNE hydrolyserar i fuktig luft och avger då vätecyanid och bör hanteras därefter.
Syntes och reaktioner
redigeraTCNE framställes genom bromering av malononitril i närvaro av kaliumbromid för att ge KBr-komplexet, och dehalogenering med koppar. Oxidation av TCNE med väteperoxid ger motsvarande epoxid, som har ovanliga egenskaper.
Redoxkemi
redigeraTCNE används ofta som en elektronacceptor. Cyanogrupper har lågenergi π* orbitaler, och närvaron av fyra sådana grupper, med deras π-system länkade (konjugerad) till den centrala C = C-dubbelbindning, ger upphov till en utmärkt acceptor. Således ger behandling av TCNE med jodidsalter den radikala anjonen:
C2(CN)4 + I− → [C2(CN)4]− + 0.5 I2
På grund av dess planhet och dess förmåga att acceptera elektroner, har TCNE använts för framställning av ett stort antal organiska supraledare, vanligtvis genom att fungera som en enelektronoxidant av en organisk elektrondonator. Sådana laddningsöverföringssalter kallas ibland Bechgaard- salter.
TCNE reagerar med elektrorika diener (Diels-Alder-reaktion) och används inom organisk syntes.
Källor
redigera- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, tidigare version.