Valens (kemi)
Valens, värdighet, är en något diffus term som sedan gammalt (1868) används inom kemin för att ange antalet bindningar som en atom kan bilda till andra atomer. Väteatomen, som endast kan binda en annan atom, sägs således ha valensen 1, syreatomen, som kan binda två andra atomer (t.ex. i vatten, H2O) har valensen 2, kväveatomen 3 och kolatomen 4. Ett och samma ämne kan dock ha olika valens i olika föreningar, således har järn i järnklorid (FeCl2) valensen 2, i järntriklorid (FeCl3) däremot 3. Valensen har numera i stor utsträckning ersatts med det mera väldefinierade begreppet oxidationstal.
Vid namngivningen av oorganiska föreningar anges ofta valensen med romerska siffror; i t.ex. järn(III)klorid (FeCl3) har järn således valens 3.
Ett ämnes valens bestäms främst av hur många valenselektroner det har. Kemiska ämnen strävar nämligen efter att via bindningar dra till sig, avge eller dela elektroner sinsemellan, för att på så sätt komplettera sitt yttersta elektronskal och därigenom uppnå ädelgasstruktur.
Begreppet valens används förutom om atomer även om atomgrupperingar eller joner; sulfatjonen (SO42-) sägs således ha valensen 2.
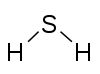
| Förening | H2 | CH4 | C3H8 | C2H2 | NH3 | NaCN | H2S | H2SO4 | Cl2O7 |
|---|---|---|---|---|---|---|---|---|---|
| Diagram | 
|

|

|
|

|

| |||
| Valenser | Väte, 1 | Kol, 4 Väte, 1 |
Kol, 4 Väte, 1 |
Kol, 4 Väte, 1 |
Kväve, 3 Väte, 1 |
Natrium, 1 Kol, 4 Kväve, 3 |
Svavel, 2 Väte, 1 |
Svavel, 6 Syre, 2 Väte, 1 |
Klor, 7 Syre, 2 |
Historik
redigeraEtymologin av ordet "valens" går tillbaka till 1425, och betyder "extrakt, förberedelse", från latinets valentia "styrka, kapacitet", från tidigare "värd, värde", och den kemiska betydelsen "ett grundämnes kombinationsstyrka" noterades från 1884, från det tyska Valenz.
År 1789 publicerade William Higgins sin syn på vad han kallade kombinationer av "ultimata" partiklar, som föregick begreppet valensbindningar. Om till exempel, enligt Higgins, kraften mellan en ultimat partikel av syre och ultimat partikel av kväve var sex, så skulle styrkan av kraften delas i enlighet därmed och likaså för andra kombinationer av slutliga partiklar (se bild).
Den tydliga starten för teorin om kemiska valenser kan emellertid spåras till 1852 i en skrift av Edward Frank, där han kombinerade äldre teorier om fria radikaler och "typteori" med tankar om kemisk affinitet för att visa att vissa partiklar har tendens att kombinera med andra element för att bilda föreningar innehållande 3, det vill säga i de tre-atomgrupper (t.ex. NO3, NH3, Ni3, etc.) eller 5, det vill säga i de fem-atomgrupper (t.ex. NO5, NH5O, PO5, etc.), ekvivalenter av de bifogade elementen. Det är på detta sätt, enligt Frankland, som deras affiniteter blir bäst uppfylld.
De flesta 1800-talskemister definierade valens av ett element som antalet av dess bindningar utan att särskilja olika typer av valens eller bindningar. Men i det av Alfred Werner 1893 beskrivna övergångsmetallkoordinationskomplexet som [Co (NH3)6] Cl3, urskiljde han primära och sekundära valenser, motsvarande de moderna begreppen oxidationstillstånd respektive koordinationstal.
För huvudgruppelement avsåg Richard Abegg 1904 positiva och negativa valenser (maximal och minimal oxidationstillstånd), och föreslog Abegg-regeln om att deras skillnad ofta är 8.
Se även
redigeraKällor
redigera- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Valence (chemistry), tidigare version.
- Bra Böckers lexikon, 1980.