Kaliumsulfid
Kaliumsulfid är en kemisk förening med formeln K2S. Denna färglösa solid påträffas sällan då ämnet raskt reagerar med vatten; en reaktion som ger kaliumvätesulfid (KSH) och kaliumhydroxid (KOH).
| Kaliumsulfid | |
 | |
| Systematiskt namn | Kaliumsulfid |
|---|---|
| Övriga namn | Dikaliumsulfid Dikaliummonosulfid Kaliummonosulfid |
| Kemisk formel | K2S |
| Molmassa | 110,262 g/mol |
| Utseende | Färglösa kristaller |
| CAS-nummer | 1312-73-8 |
| Egenskaper | |
| Densitet | 1,8 g/cm³ |
| Löslighet (vatten) | omvandlas till KSH och KOH |
| Smältpunkt | 840 °C |
| Kokpunkt | (söderdelas) |
| Faror | |
| NFPA 704 | |
| SI-enheter & STP används om ej annat angivits | |
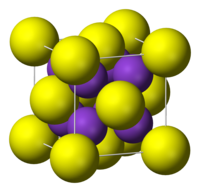
Struktur redigera
Kaliumsulfid antar antifluoritstruktur, vilket betyder att de små K+-jonerna upptar de tetrahedrala (F-) platserna i fluorit, och de större S2--jonerna upptar de åttakoordinerade Ca2+-platserna. Litiumsulfid (Li2S), natriumsulfid (Na2S) och rubidiumsulfid (Rb2S) kristalliserar sig på samma sätt.
Tillverkning och reaktioner redigera
K2S uppstår från reaktionen av kalium och svavel. I laboratoriet utförs denna syntes vanligtvis genom att kombinera en lösning av kalium i vattenfri ammoniak med rent svavel.
Detta salt innehåller den starkt basiska anjonen S2−, som fullständigt hydrolyseras i vatten enligt följande reaktionsformel:
- K2S + H2O → KOH + KSH
Denna reaktion är dock inkonsekvent eftersom blandningen av SH− och OH− beter sig som en källa till S2−. Andra alkalimetallsulfider beter sig på samma sätt.
Användningsområden redigera
Kaliumsulfider bildas när krut förbränns och är viktiga intermediat i många pyrotekniska effekter, såsom senko hanabi och vissa glitterprodukter.
Se även redigera
Källor redigera
- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Potassium sulfide, 26 februari 2010.
