Cytokrom c
Cytokrom c är ett protein i gruppen cytokromer, en grupp hemoproteiner som finns i de flesta aeroba organismer. Cytokromer är på grund av att de innehåller en eller flera hemgrupper rödbruna till färgen. Till skillnad från järnjonerna i hemgruppen hos hemoglobin och myoglobin, som konstant är i ferro-form, dvs Fe2+,[1] kan cytokromernas järnjoner delta i redoxreaktioner. Cytokromer har flera centrala funktioner i cellen och deltar bland annat i cellandningen och fotosyntesen.[2] Av det trettiotal cytokromer som har identifierats är cytokrom c den mest stabila och vanligt förekommande, och är därför den cytokrom som har studerats mest utförligt.
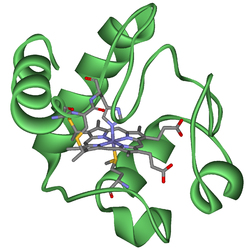
På grund av dess storlek, drygt 100 aminosyror, har cytokrom c studerats noggrant. Eftersom proteinet är vattenlösligt är det relativt lätt att separera ifrån andra proteiner och studera. Många andra proteiner är nämligen fettlösliga och betydligt större än cytokrom c[3].
Förekomst redigera
Bakterierna som gett upphov till mitokondrier hade både cytokrom c och det alternativa enzymet AOX som normalt är mindre effektivt än cytokrom c men okänsligt för cyanid. Växter har fortfarande båda enzymerna, men AOX har gått förlorat hos flera organismer bland annat däggdjur och Saccharomyces cerevisiae[4].
Hos trypanosoma har däremot cytokrom c gått förlorat och AOX finns kvar[5].
Cytokrom c anses ha uppstått hos bakterier från cytokrom b. Bakterier har flera andra cytokromer, som till skillnad från eukaryoter kan ha flera hemgrupper[6].
Cellandning redigera
Cytokrom c finns på utsidan av mitokondriernas innermembran, där det ingår i elektrontransportkedjan, en process som även kallas oxidativ fosforylering.[8] Energirika elektroner från vätebärarna NADH och FADH2 vandrar genom mitokondriens innermembran så att en protongradient uppstår då protoner transporteras från matrix, genom det inre membranet, till det intermembranära området. Denna gradient driver i sin tur ATP-syntesen, då ATP bildas från ADP och Pi. Cytokrom c fungerar som en elektronacceptor respektive -donator, tack vare järnet i proteinets hemgrupp som reduceras respektive oxideras. På så sätt kan det transportera elektroner mellan Komplex III och Komplex IV i elektrontransportkedjan.[9]
Apoptos redigera
Cytokrom c spelar en avgörande roll i apoptosen, den vanligaste formen av programmerad celldöd. Apoptos har en central betydelse i djurs och växters utveckling, men även under vuxet stadium. I en vuxen, frisk människa dör miljontals celler i benmärgen och tarmarna varje timme till följd av apoptos. På så vis är celldelning och celldöd i balans, tack vare i nuläget okända regulatoriska mekanismer. Apoptosen är karaktäriseras av att cellen genomgår specifika morfologiska förändringar då den krymper och kondenserar, DNA bryts ned och cellskelettet kollapsar. Vanligen delar cellen upp sig i mindre fragment, så kallade apoptotiska kroppar, som sedan fagocyteras av omkringliggande celler eller makrofager.[10]
Apoptosen sker i motsats till nekros under kontrollerade former och ger vanligen ej upphov till en inflammatorisk reaktion. Nekros kallas den process då celler dör plötsligt och oplanerat till följd av t.ex. värmeskada eller brist på blodtillförsel. Processen innebär att cellen sväller upp och spricker, så att dess innanmäte, som potentiellt innehåller toxiska ämnen, sprids i dess omgivning och sätter igång en inflammatorisk reaktion.[10]
Av de två mest välkända signalvägar som kan initiera apoptos i däggdjursceller är den ena externt orsakad och den andra internt orsakad. En internt orsakad apoptos sker ofta som reaktion på skador på DNA eller brist på syre, näringsämnen eller tillväxtfaktorer. Den beror på att intermembranära proteiner i mitokondrien frisätts till cytosolen. Cytokrom c är ett betydelsefullt protein som frisätts och får därmed en helt annan funktion än den normalt har i elektrontransportkedjan. Frisättning av cytokrom c aktiverar caspaser som i sin tur sätter igång en proteolytisk kaskad och inleder apoptosen. Caspaser är en grupp proteaser och utgör effektormolekyler vid apoptos. Alla casapaser är dock inte kopplade till apoptos utan en del är istället involverade i immunologiska reaktioner. Caspaser förekommer vanligen i inaktivt tillstånd, sk. procaspaser, som sedan aktiveras då apoptos utlöses.[10]
Internt orsakad apoptos initieras av att cytokrom c binder till ett adaptorprotein (Apaf-1), vilket leder till autoaktivering av procaspas.[9] Aktiveringen sker genom proteolytisk klyvning, en irreversibel reaktion som vanligen katalyseras av redan aktiva caspaser. Procaspaser klyvs i detta steg till en större och en mindre subenhet, för att sedan genom dimerisering bilda en tetramer tillsammans med ytterligare en aktiverad procaspas. Aktiveringen av caspas sätter igång en kedjereaktion genom att fler procaspaser aktiveras av aktiva caspaser. Caspaser katalyserar nedbrytande processer i cellen och utlöser därmed apoptosen.[10] Frisättningen av cytokrom c regleras av proteiner bcl-2-familjen.[9]
Externt orsakad apoptos initieras då extracellulära signalproteiner binder till sk. celldödsreceptorer. Vanligen är det lymfocyter som triggar den här typen av apoptos hos t.ex. virusinfekterade celler och den utgör därför en viktig del av immunförsvaret.[10]
Cytokrom c i evolutionsstudier redigera
Cytokrom c har haft stor betydelse vid evolutionära studier kopplade till mutationer. Genom att jämföra aminosyrasekvensen för ett visst protein i två olika arter med en gemensam stamform kan mutationshastigheten för DNA uppskattas, givet att den estimerade tiden sedan arterna divergerade från den gemensamma stamformen är känd. Därmed ges en indikation på hur många år som i genomsnitt krävs för att en förändring i aminosyrasekvensen blir nedärvd i en organism. Varje sådan förändring i sekvensen motsvaras vanligen av en punktmutation i genen som kodar för proteinet i fråga.[10]
Dessa beräkningar kommer emellertid nästintill alltid att avsevärt underskatta den verkliga mutationshastigheten eftersom de mutationer som leder till att cellen eller organismen dör inte syns i beräkningarna. De flesta gener tolererar endast mycket små förändringar för att den fortsatt ska vara funktionell. Fibrinopeptider är dock exempel på proteiner vars aminosyrasekvens tolererar förändringar i högre grad, vilket gör att mutationer kan ackumuleras. Det beror på att dessa 20 aminosyror långa peptider avlägsnas då fibrinogen aktiveras för att bilda fibrin vid blodkoagulering och därför saknar självständig funktion.[10] Cytokrom c, å andra sidan, har en låg mutationshastighet eftersom dess struktur har större betydelse för dess funktion. Vid en jämförelse av cytokrom c hos ett stort antal arter har det visat sig att 35 av 104 aminosyror är oförändrade. Ju större skillnad i aminosyrasekvens mellan två arter, desto större fylogenetiskt avstånd. Genom att studera skillnader i aminosyrasekvensen för olika arter kan således evolutionära släktskap kartläggas.[9]
Referenser redigera
- ^ ”hem - Uppslagsverk - NE.se”. www.ne.se. https://www.ne.se/uppslagsverk/encyklopedi/l%C3%A5ng/hem. Läst 16 april 2020.
- ^ ”cytokromer - Uppslagsverk - NE.se”. www.ne.se. https://www.ne.se/uppslagsverk/encyklopedi/l%C3%A5ng/cytokromer. Läst 16 april 2020.
- ^ New World, Encyclopedia. ”Cytochrome c”. New World Encyclopedia. http://www.newworldencyclopedia.org/entry/Cytochrome_c. Läst 14 mars 2019.
- ^ Pierron, Denis; Wildman, Derek E.; Hüttemann, Maik; Markondapatnaikuni, Gopi Chand; Aras, Siddhesh; Grossman, Lawrence I. (2012). ”Cytochrome c oxidase: Evolution of control via nuclear subunit addition”. Biochimica et Biophysica Acta (BBA) - Bioenergetics (Elsevier BV) 1817 (4): sid. 590–597. doi:. ISSN 0005-2728.
- ^ Chaudhuri, Minu; Ott, Robert Daniel; Hill, George C. (2006). ”Trypanosome alternative oxidase: from molecule to function”. Trends in Parasitology (Elsevier BV) 22 (10): sid. 484–491. doi:. ISSN 1471-4922.
- ^ Edwards, Marcus J.; Richardson, David J.; Paquete, Catarina M.; Clarke, Thomas A. (28 November 2019). ”Role of multiheme cytochromes involved in extracellular anaerobic respiration in bacteria”. Protein Science (Wiley) 29 (4): sid. 830–842. doi:. ISSN 0961-8368.
- ^ Kletzin, Arnulf; Heimerl, Thomas; Flechsler, Jennifer; Niftrik, Laura van; Rachel, Reinhard; Klingl, Andreas (13 December 2020). ”Cytochromes c in Archaea: distribution, maturation, cell architecture, and the special case of Ignicoccus hospitalis”. Frontiers in Microbiology 6. doi:. PMID 26029183. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4429474/. Läst 14 december 2020.
- ^ ”cellular respiration | Process & Products” (på engelska). Encyclopedia Britannica. https://www.britannica.com/science/cellular-respiration. Läst 29 april 2020.
- ^ [a b c d] Erlanson-Albertsson, Charlotte, 1947- (2007). Cellbiologi (2., [rev. och uppdaterade] uppl). Studentlitteratur. ISBN 91-44-04738-X. OCLC 185246172. https://www.worldcat.org/oclc/185246172. Läst 29 april 2020
- ^ [a b c d e f g] Alberts, Bruce. (2008). Molecular biology of the cell.. Garland Science. ISBN 978-0-8153-4111-6. OCLC 181926875. http://worldcat.org/oclc/181926875. Läst 29 april 2020