Asparagin
Asparagin (förkortas Asn eller N), amidobärnstensyreaminsyra, är en kemisk förening med formeln C2H3(NH2)(CONH2)COOH, summaformel C4H8N2O3, som används vid biosyntes av proteiner.
| Asparagin | |
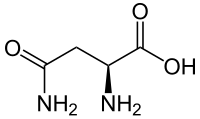  | |
| Systematiskt namn | (2S)-2-amino-3-karbamoylpropansyra |
|---|---|
| Övriga namn | 2-amino-3-karbamoylpropanoiksyra |
| Kemisk formel | C4H8N2O3 |
| Molmassa | 132,118 g/mol |
| Utseende | Vita kristaller |
| CAS-nummer | 70-47-3 |
| SMILES | N[C@@H](CC(N)=O)C(O)=O |
| Egenskaper | |
| Densitet | 1,543 g/cm³ |
| Löslighet (vatten) | 2,94 g/100 ml i vatten, löslig i syror, baser, försumbar i metanol, etanol, eter, bensen g/l |
| Smältpunkt | 234 °C |
| Kokpunkt | 438 °C |
| Faror | |
| NFPA 704 | |
| SI-enheter & STP används om ej annat angivits | |
Ämnet är en av de 20 aminosyrorna som är byggstenar i proteiner. Ämnet tillhör gruppen hydrofila, polära aminosyror. Asparagin är monoamiden av asparaginsyra. I den genetiska koden kodas asparagin av två kodon: AAU och AAC.
Historik redigera
Asparagin isolerades först 1806 i kristallin form av franska kemister Louis Nicolas Vauquelin och Pierre Jean Robiquet (då en ung assistent). Det isolerades från sparrisjuice,[1][2] där det är rikligt förekommande, därav det valda namnet. Det var den första aminosyran som isolerades.[3]
Tre år senare, 1809, identifierade Pierre Jean Robiquet ett ämne från lakritsrot med egenskaper som han kvalificerade som mycket lika asparagin,[4] och som Plisson 1828 identifierade som rent asparagin.[5][6]
Bestämningen av asparagins struktur krävde årtionden av forskning. Den empiriska formeln för asparagin bestämdes först 1833 av de franska kemisterna Antoine François Boutron Charlard och Théophile-Jules Pelouze och samma år gav den tyska kemisten Justus Liebig en mer exakt formel.[7][8] År 1846 behandlade den italienska kemisten Raffaele Piria asparagin med salpetersyra, vilket tog bort molekylens amingrupper (–NH2) och omvandlade asparagin till äppelsyra.[9] Detta avslöjade molekylens grundläggande struktur som en kedja av fyra kolatomer. Piria trodde att asparagin var en diamid av äppelsyra,[10] men 1862 visade den tyska kemisten Hermann Kolbe att detta antagande var fel. Istället drog Kolbe slutsatsen att asparagin var en amid av en amin av bärnstenssyra.[11]
År 1886 upptäckte den italienska kemisten Arnaldo Piutti (1857–1928) en spegelbild eller "enantiomer" av den naturliga formen av asparagin, som delade många av asparaginens egenskaper, men som också skilde sig från den.[12] Eftersom strukturen av asparagin fortfarande inte var helt känd - platsen för amingruppen i molekylen var fortfarande inte avgjord - syntetiserade Piutti asparagin och publicerade därmed 1888 dess sanna struktur.[13]
Strukturell funktion i proteiner redigera
Eftersom asparaginens sidokedja kan bilda vätebindningsinteraktioner med peptidens ryggrad, finns asparaginrester ofta nära början av alfahelixer som asxvändningar och asxteman, och i liknande vändteman, eller som amidringar, i betaplattor. Dess roll kan ses som att "täcka" vätebindningsinteraktionerna som annars skulle uppfyllas av polypeptidstommen.
Asparagin ger också nyckelplatser för N-länkad glykosylering, modifiering av proteinkedjan med tillsats av kolhydratkedjor. Vanligtvis kan ett kolhydratträd enbart tillsättas till en asparaginrest om den senare flankeras på C-sidan av X-serin eller X-treonin, där X är vilken aminosyra som helst med undantag för prolin.[14]
Asparagin kan hydroxyleras i HIF1 hypoxiinducerbar transkriptionsfaktor. Denna modifiering hämmar HIF1-medierad genaktivering.[15]
Källor redigera
Kostkällor redigera
Asparagin är inte nödvändigt för människor, vilket innebär att det kan syntetiseras från centrala metaboliska mellanprodukter och krävs inte i kosten.
Asparagin finns i:
- Animaliska källor: mejeri, vassle, nötkött, fjäderfä, ägg, fisk, laktalbumin, skaldjur
- Växtkällor: sparris, potatis, baljväxter, nötter, frön, soja, fullkorn
Biosyntes och katabolism redigera
Föregångaren till asparagin är oxaloacetat, som ett transaminasenzym omvandlar till aspartat. Enzymet överför aminogruppen från glutamat till oxaloacetat som producerar α-ketoglutarat och aspartat. Enzymet asparaginsyntetas producerar asparagin, AMP, glutamat och pyrofosfat från aspartat, glutamin och ATP. Asparaginsyntetas använder ATP för att aktivera aspartat och bildar β-aspartyl-AMP. Glutamin donerar en ammoniumgrupp som reagerar med β-aspartyl-AMP för att bilda asparagin och fri AMP.[16]
Som reaktion som är motsatsen till dess biosyntes hydrolyseras asparagin till aspartat av asparaginas. Aspartat genomgår sedan transaminering för att bilda glutamat och oxaloacetat från alfa-ketoglutarat. Oxaloacetat, som går in i citronsyracykeln (Krebs-cykeln).[16]
Akrylamidkontrovers redigera
Uppvärmning av en blandning av asparagin och reducerande sockerarter eller annan källa till karbonyler producerar akrylamid i livsmedel. Dessa produkter förekommer i bakverk som pommes frites, potatischips och rostat bröd. Akrylamid omvandlas i levern till glycidamid, vilket är ett möjligt cancerframkallande ämne.[17]
Funktion redigera
Asparagin krävs för hjärnans utveckling och funktion.[18] Tillgängligheten av asparagin är också viktigt för proteinsyntesen under replikation av poxvirus.[19]
Tillsatsen av N-acetylglukosamin till asparagin utförs av oligosackaryltransferasenzymer i endoplasmatiska nätverket.[20] Denna glykosylering är viktig både för proteinstruktur[21] och proteinfunktion.[22]
Referenser redigera
- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Asparagine, 31 maj 2022.
Noter redigera
- ^ ”La découverte d'un nouveau principe végétal dans le suc des asperges” (på franska). Annales de Chimie 57: sid. 88–93. 1806.
- ^ The chemical composition of the proteins. Monographs on biochemistry. "Part I. Analysis" (2nd). London: Longmans, Green and Co. 1912. Sid. 112. https://books.google.com/books?id=7JM8AAAAIAAJ&pg=PA112. Läst 18 januari 2010.
- ^ Advances in Protein Chemistry. New York: Academic Press. 1972. Sid. 99, 103. ISBN 978-0-12-034226-6. https://archive.org/details/advancesinprotei26anfi/page/99.
- ^ ”Analyse de la racine de réglisse” (på franska). Annales de Chimie et de Physique 72 (1): sid. 143–159. 1809. https://babel.hathitrust.org/cgi/pt?id=mdp.39015065225404;view=1up;seq=143.
- ^ ”De l'indentité de l'asparagine avec l'agédoïte” (på franska). Journal de Pharmacie et des Sciences Accessoires 14 (4): sid. 177–182. 1828. https://books.google.com/books?id=ELgal5J1G5AC&pg=PA177.
- ^ Felter, Harvey Wickes; Lloyd, John Uri (1898). ”Glycyrrhiza (U. S. P.)—Glycyrrhiza”. King's American Dispensatory. Henriette's Herbal Homepage.
- ^ Boutron-Charlard; Pelouze (1833). ”Ueber das Asparamid (Asparagin des Herrn Robiquet) und die Asparamidsäure” (på tyska). Annalen der Chemie 6: sid. 75–88. doi:. https://babel.hathitrust.org/cgi/pt?id=uva.x002457885;view=1up;seq=467. The empirical formula of asparagine appears on p. 80.
- ^ Liebig, Justus (1833). ”Ueber die Zusammensetzung des Asparamids und der Asparaginsäure” (på tyska). Annalen der Chemie 7 (14): sid. 146–150. doi:. Bibcode: 1834AnP...107..220L. https://babel.hathitrust.org/cgi/pt?id=uva.x002457886;view=1up;seq=156. The empirical formula appears on p. 149 ; the formula is correct if the subscripts are divided by 2.
- ^ Piria, Raffaele (January 1846). ”Studi sulla costituzione chimica dell' asparagina e dell' acido aspartico” (på italienska). Il Cimento 4: sid. 55–73. doi:. https://books.google.com/books?id=5ptZAAAAYAAJ&pg=PA55.
- ^ Plimmer, Robert Henry Aders (1912). The Chemical Constitution of the Proteins. Part I: Analysis (2nd). London, England: Longmans, Green and Co. Sid. 112. https://books.google.com/books?id=EaAhAQAAMAAJ&pg=PA112.
- ^ Kolbe, Hermann (1862). ”Ueber die chemische Constitution des Asparagins und der Asparaginsäure” (på tyska). Annalen der Chemie 121 (2): sid. 232–236. doi:. https://babel.hathitrust.org/cgi/pt?id=uva.x002457960;view=1up;seq=244.
- ^ ”Ein neues Asparagin” (på tyska). Berichte der Deutschen Chemischen Gesellschaft 19 (2): sid. 1691–1695. 1886. doi:. https://babel.hathitrust.org/cgi/pt?id=osu.32435060218146;view=1up;seq=903.
- ^ ”Sintesi e costituzione delle asparagine” (på italienska). Gazzetta Chimica Italiana 18: sid. 457–472. 1888. https://babel.hathitrust.org/cgi/pt?id=mdp.39015036973934;view=1up;seq=471.
- ^ Brooker, Robert; Widmaier, Eric; Graham, Linda; Stiling, Peter; Hasenkampf, Clare; Hunter, Fiona; Bidochka, Michael; Riggs, Daniel (2010). ”Chapter 5: Systems Biology of Cell Organization”. Biology (Canadian). United States of America: McGraw-Hill Ryerson. Sid. 105–106. ISBN 978-0-07-074175-1.
- ^ ”FIH-1 is an asparaginyl hydroxylase enzyme that regulates the transcriptional activity of hypoxia-inducible factor”. Genes & Development 16 (12): sid. 1466–71. June 2002. doi:. PMID 12080085.
- ^ [a b] Berg, Jeremy; Tymoczko, John; Stryer, Lubert (2002). Biochemistry (5th). New York: W. H. Freeman. Sid. 968. ISBN 0716746840. https://www.ncbi.nlm.nih.gov/books/bv.fcgi?call=bv.View..ShowTOC&rid=stryer.TOC. Läst 27 maj 2021.
- ^ Friedman, Mendel (2003). ”Chemistry, Biochemistry, and Safety of Acrylamide. A Review”. Journal of Agricultural and Food Chemistry 51 (16): sid. 4504–4526. doi:. PMID 14705871.
- ^ ”Deficiency of asparagine synthetase causes congenital microcephaly and a progressive form of encephalopathy”. Neuron 80 (2): sid. 429–41. October 2013. doi:. PMID 24139043.
- ^ ”Asparagine Is a Critical Limiting Metabolite for Vaccinia Virus Protein Synthesis during Glutamine Deprivation”. Journal of Virology 93 (13): sid. e01834–18, /jvi/93/13/JVI.01834–18.atom. July 2019. doi:. PMID 30996100.
- ^ ”The dolichol pathway of N-linked glycosylation”. Biochimica et Biophysica Acta (BBA) - General Subjects 1426 (2): sid. 239–57. January 1999. doi:. PMID 9878760.
- ^ ”Effect of N-linked glycosylation on glycopeptide and glycoprotein structure”. Current Opinion in Chemical Biology 3 (6): sid. 643–9. December 1999. doi:. PMID 10600722.
- ^ ”Metabolic mimics: the disorders of N-linked glycosylation”. Seminars in Pediatric Neurology 12 (3): sid. 144–51. September 2005. doi:. PMID 16584073.
Externa länkar redigera
- Wikimedia Commons har media som rör Asparagin.
- GMD MS Spectrum
